
(2分)在一密闭容器中反应2SO2+O2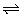 2SO3经5秒后,SO3的浓度增加了0.4mol·L-1,则在这段时间内用O2表示的反应速率为
mol·L-1·s-1。
2SO3经5秒后,SO3的浓度增加了0.4mol·L-1,则在这段时间内用O2表示的反应速率为
mol·L-1·s-1。
 互动课堂系列答案
互动课堂系列答案 激活思维智能训练课时导学练系列答案
激活思维智能训练课时导学练系列答案科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
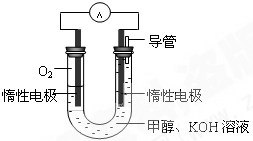 甲醇是重要的化工原料,在日常生活中有着广泛的应用.
甲醇是重要的化工原料,在日常生活中有着广泛的应用. CH3OH(g)△H1
CH3OH(g)△H1 CH3OH(g)+H2O(g)△H2
CH3OH(g)+H2O(g)△H2| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、X2为0.2 mol/L | B、Y2为0.2 mol/L | C、Z2为0.4 mol/L | D、Y2为0.6 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、单位时间内生成n mol X,同时消耗2n mol Z | B、反应体系压强不随时间而改变 | C、反应体系的平均相对分子质量不随时间而改变 | D、Y的生成速率与Z的生成速率之比为1:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.45 mol/L | B、0.6 mol/L | C、0.9 mol/L | D、1.2 mol/L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com