
科目:高中化学 来源: 题型:选择题
| A. | 同系物 | B. | 同位素 | C. | 同分异构体 | D. | 同素异形体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.12L | B. | 2.24L | C. | 3.36L | D. | 4.48L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 陈述I | 陈述II |
| A | 除去苯中的苯酚杂质,向其中加入足量的溴水,过滤 | 苯酚与溴水反应生成难溶于水的沉淀,故可过滤除去 |
| B | 醋酸加入到碳酸钠固体中,将产生的气体通入C2H5ONa中,溶液变浑浊 | 可证明酸性:CH3COOH>H2CO3>C2H5OH |
| C | 将CH3CH2Br与NaOH 乙醇溶液共热产生的气体通入溴水中,溶液褪色 | 可证明该反应产生乙烯 |
| D | 氯乙烷中加入NaOH溶液共热,冷却后滴入AgNO3溶液,有白色沉淀生成 | 可证明氯乙烷中有氯元素存在 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
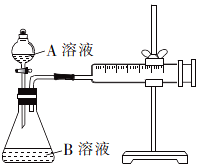 草酸与高锰酸钾在酸性条件下能够发生反应:MnO4-+H2C2O4+H+→Mn2++CO2↑+H2O(未配平).甲、乙两个实验小组分别利用酸性KMnO4溶液和H2C2O4溶液的反应来研究外界因素对反应速率的影响.
草酸与高锰酸钾在酸性条件下能够发生反应:MnO4-+H2C2O4+H+→Mn2++CO2↑+H2O(未配平).甲、乙两个实验小组分别利用酸性KMnO4溶液和H2C2O4溶液的反应来研究外界因素对反应速率的影响.| 实验编号 | A溶液 | B溶液 |
| ① | 2mL 0.1mol/LH2C2O4溶液 | 4mL0.0l mol/L酸性KMnO4溶液 |
| ② | 2mL 0.2mol/LH2C2O4溶液 | 4mL0.0l mol/L酸性KMnO4溶液 |
| 实验编号 | 10%硫酸的体积/mL | 温度/℃ | 其他物质 |
| Ⅰ | 2 | 20 | - |
| Ⅱ | 2 | 20 | 少量MnSO4粉末 |
| Ⅲ | 2 | 30 | - |
| Ⅳ | 1 | 20 | 1mL蒸馏水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
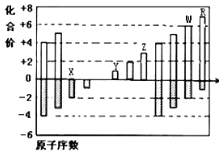 如图是部分短周期元素化合价与原子序数的关系图,请根据图中给出的信息,指出下列有关说法中正确的是(纵坐标为化合价的变化,横坐标为原子序数的变化)( )
如图是部分短周期元素化合价与原子序数的关系图,请根据图中给出的信息,指出下列有关说法中正确的是(纵坐标为化合价的变化,横坐标为原子序数的变化)( )| A. | 原子半径:W>Z>Y | |
| B. | 气态氢化物的稳定性:H2X<H2W | |
| C. | Y2X和水反应能生成离子化合物 | |
| D. | Y和Z两者氧化物对应的水化物不能相互反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | M能发生酯化、加成、氧化反应 | |
| B. | 用碳酸氢钠不能检验M分子中存在羧基 | |
| C. | M的分子式为C8H8O4 | |
| D. | M的苯环上一氯代物有2种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH3易液化,液氨常用作制冷剂 | |
| B. | 稀HNO3氧化能力弱于浓HNO3 | |
| C. | 贮存铵态氮肥时要密封保存,并放在阴凉处 | |
| D. | 硝酸只能被Zn、Fe等金属还原成H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
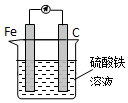
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com