
金属钛性能优越,被誉为继Fe、Al后应用广泛的“第三金属”。
(1)写出Ti基态原子的电子排布 。
(2)钛能与B、C、N、O等非金属元素形成稳定的化合物。则电负性C B(选填“>”“<”),第一电离能N>O,原因是 。
(3)月球岩石玄武岩的主要成分为钛酸亚铁(FeTiO3)。FeTiO3与80%的硫酸反应可生成TiOSO4。SO42-的空间构型为 ,其中硫原子采用 杂化,氧原子的价电子排布图为 ,任意写出一种SO42-等电子体 。
(4)将TiOSO4的稀溶液加热水解后,经进一步反应,可得到钛的某种氧化物。该氧化物的晶胞结构图如图所示。
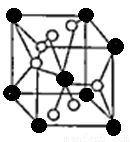
则该氧化物的化学式 (图中钛原子用“O”表示。氧原子用“O”表示)
(1)1s22s22p63s23p63d24s2
(2)> N原子2p上处于半充满状态,比较稳定,所以第一电离能N>O
(3)正四面体;sp3 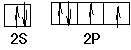 CCl4或ClO4-或S2O32-或PO43-
CCl4或ClO4-或S2O32-或PO43-
(4)TiO2
【解析】(1)Ti是22元素,核外电子排布式是1s22s22p63s23p63d24s2
(2)非金属性越强,电负性越大,所以电负性C大于B;N原子2p上处于半充满状态,比较稳定,所以第一电离能N>O;
(3)SO42-是AB4型,原子的孤对电子对数是(6+2-4×2)/2=0,所以立体构型是正四面体,采取sp3杂化;氧原子价电子是6,其价电子排布图是, ,与SO42-互为等电子体是5个原子,价电子数是32个,因而符合的有CCl4或ClO4-或S2O32-或PO43-;
,与SO42-互为等电子体是5个原子,价电子数是32个,因而符合的有CCl4或ClO4-或S2O32-或PO43-;
(4)O的个数是4×1/2+2=4,Ti的个数是8×1/8+1=2,该晶体的化学式为TiO2。


 新编小学单元自测题系列答案
新编小学单元自测题系列答案 字词句段篇系列答案
字词句段篇系列答案科目:高中化学 来源:2015安徽望江中学同步练(人教选修4)2.3化学平衡状态的建立及标志(解析版) 题型:选择题
在一定温度下,将等物质的量的CO和水蒸气通入恒容密闭容器中,发生如下反应:
CO(g)+H2O(g)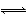 CO2(g)+H2(g),一段时间后反应达到平衡。对该平衡状态描述正确的是( )
CO2(g)+H2(g),一段时间后反应达到平衡。对该平衡状态描述正确的是( )
A.正反应速率等于零 B.正反应速率大于逆反应速率
C.正反应速率等于逆反应速率 D.正反应速率小于逆反应速率
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学钠及其化合物主要性质(解析版) 题型:选择题
有A、B、C、D、E和F六瓶无色溶液,它们都是中学化学中常用的无机试剂。E的溶质是一种无色油状液体;B、C、D和F是盐溶液,且它们的阴离子均不同。现进行如下实验:
①A有刺激性气味,用沾有浓盐酸的玻璃棒接近A时产生白色烟雾;②将A分别加入其他五种溶液中,只有D、F中有沉淀产生,继续加入过量A时,D中沉淀无变化,F中沉淀完全溶解;③将B分别加入C、D、E、F中,C、D、F中产生沉淀,E中有无色、无味气体逸出;④将C分别加入D、E、F中,均有沉淀生成,再加入稀HNO3,沉淀均不溶。根据上述实验信息,下列说法错误的是
A.B可能是NaHCO3溶液
B.F为AgNO3溶液
C.D不可能是镁或铝的盐酸盐
D.A为氨水,E为硫酸
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学选做题练习5(解析版) 题型:填空题
A~F均为元素周期表中前四周期元素,其相关信息如下表:
元素 | 相 关 信 息 |
A | A的基态原子最外层电子排布式为2s22p3 |
B | B是地壳中含量最高的元素 |
C | C+与B的简单离子的电子层结构相同 |
D | D的一种核素的质量数为64,中子数为35 |
E 、F | E 、F既同周期又同族,且原子序数F比E多2 |
请回答下列问题:
(1)D的价电子的电子排布式是 ;F原子的原子结构示意图为 。
(2)A、B的第一电离能的大小顺序为 。
(3)AB3-中A原子的杂化轨道类型为_____;与A2B互为等电子体的分子的分子式为 (任写一个即可)。
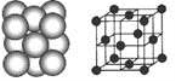
(4) D晶体的晶胞如图所示为面心立方最密堆积(在晶胞的顶点和面心均含有一个D原子)。则D的晶体中D原子的配位数为 。
(5)已知17gA的简单氢化物催化氧化生成气态水时放出QkJ的热量,请写出A的简单氢化物催化氧化的热化学反应方程式 。
(6)C2B2的电子式为____;它可与E的二氯化物溶液反应,若反应的C2B2与E的二氯化物的物质的量之比为1:2,则该反应的化学反应方程式为 。
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学选做题练习5(解析版) 题型:填空题
有机物A、B的分子式均为C10H10O5,均能发生如下变化。
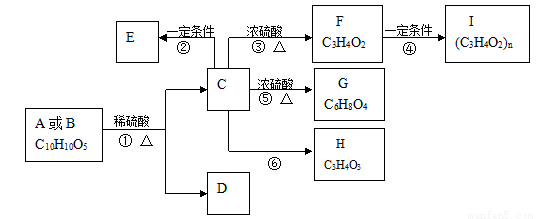
已知:
①A、B、C、D等均能与NaHCO3反应
②只有A、D能与FeCl3溶液发生显色反应,A苯环上的一溴代物只有两种
③F能使溴水褪色,
④H不能发生银镜反应
根据题意回答下列问题:
(1)反应③的反应类型是 ;有机物F含氧官能团的名称是 ;
(2)写出有机物的结构简式D 、H ;
(3)写出反应⑤的化学方程式 ;
(4)D的同分异构体有很多种,写出同时满足下列要求的所有同分异构体的结构简式 ;
①能与FeCl3溶液发生显色反应
②能发生银镜反应但不能水解
③苯环上的一卤代物只有2种
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学选做题练习3(解析版) 题型:填空题
水是一种重要的自然资源,是人类赖以生存不可缺少的物质。水质优劣直接影响人体健康。
(1)含有较多 的水称为硬水,硬水加热后产生沉淀的离子方程式为____________(写出生成一种沉淀物的即可)。
(2)下图为某饮用水厂从天然水制备纯净水(去离子水)的工艺流程示意图:
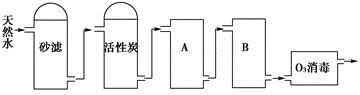
①活性炭的作用是____________;O3消毒的优点是___________。
②A、B中放置的物质名称分别是A_________;B__________。A、B中放置的物质是否可以互换?请说明原因__________。
(3)通过施加一定压力使水分子通过半透膜而将大分子或离子截留, 从而获得纯净水的方法称为 。电渗析法净化水时, 使离子通过半透膜的推动力是 。
(4)检验蒸馏水的纯度时, 最简单易行的方法是测定水的 。
(5)某城市用水中,c(Ca2+)为1.0×10-3mol/L, c(Mg2+)为5.0×10-4mol/L,c(HCO3-)为8.0×10-4mol/L。如用药剂软化该水1000L,应加入Ca(OH) 2 g, Na2CO3__________ g
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学选做题练习3(解析版) 题型:填空题
Cu3N具有良好的电学和光学性能,在电子工业领域、航空航天领域、国防领域、通讯领域以及光学工业等领域中,发挥着广泛的、不可替代的巨大作用。
(1)与N3-含有相同电子数的三原子分子的空间构型是 。
(2)Cu具有良好的导电、导热和延展性,请解释Cu具有导电性的原因 。
(3)在Cu的催化作用下,乙醇可被空气氧化为乙醛,乙醛分子中碳原子的杂化方式是__________,乙醛分子中H—C—O的键角__________乙醇分子中的H—C—O的键角(填“大于”、“等于”或“小于”)。
(4)Cu+的核外电子排布式为 ,其在酸性溶液中不稳定,可发生歧化反应生成Cu2+和Cu,但CuO在高温下会分解成Cu2O,试从结构角度解释高温下CuO为何会生成Cu2O 。
(5)[Cu(H2O)4]2+为平面正方形结构,其中的两个H2O被Cl-取代有两种不同的结构,试画出[Cu(H2O)2(Cl)2]具有极性的分子的结构式 。
(6)Cu3N的晶胞结构下图所示:
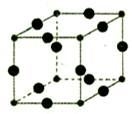
N3-的配位数为__________,Cu+半径为apm,N3-半径为b pm,Cu3N的密度__________g/cm3。(阿伏加德罗为常数用NA表示)
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学选做题练习1(解析版) 题型:填空题
草酸(乙二酸)可作还原剂和沉淀剂,用于金属除锈、织物漂白和稀土生产。一种制备草酸(含2个结晶水)的工艺流程如下:
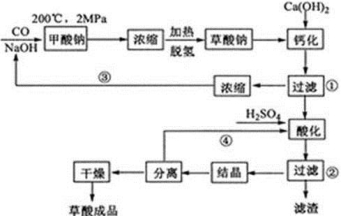
回答下列问题:
(1)CO和NaOH在一定条件下合成甲酸钠、甲酸钠加热脱氢的化学反应方程式分别为 。
(2)该制备工艺中有两次过滤操作,过滤操作①的滤液是 ,滤渣是 ;过滤操作②的滤液是 和 ,滤渣是 。
(3)工艺过程中③和④的目的是 。
(4)有人建议甲酸钠脱氢后直接用硫酸酸化制备草酸。该方案的缺点是产品不纯,其中含有的杂质主要是 。
(5)结晶水合草酸成品的纯度用高锰酸钾法测定。称量草酸成品0.250g溶于水中,用0.0500 mol/L的酸性KMnO4溶液滴定,至粉红色不消褪,消耗KMnO4溶液15.00mL,反应的离子方程式为 ;列式计算该成品的纯度 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com