
【题目】下列属于取代反应的是( )
A.光照射甲烷与氯气的混合气体 B.乙烯通入溴水
C.苯在氧气中燃烧 D.乙烯生成聚乙烯
科目:高中化学 来源: 题型:
【题目】下表是生活生产中常见的物质,表中列出了它们的(主要)成分。
编号 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ |
名称 | 酒精 | 醋酸 | 火碱 | 食盐 | 铜导线 | 亚硫酸酐 | 苏打 |
主要成分 | CH3CH2OH | CH3COOH | NaOH | NaCl | Cu | SO2 | Na2CO3 |
(1)请你对表中①~⑦的主要成分进行分类(填编号):属于电解质的是_________,属于非电解质的是______________。
(2)过量②的水溶液与⑦反应的离子方程式______________________。
(3)某同学用⑤和浓硫酸共热来制备⑥,化学方程式为:Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O
①请用双线桥标出电子转移的方向和数目;
②被氧化与未被氧化的H2SO4的物质的量之比为___________,当电子转移0.1mol时,消耗还原剂的质量为_______________。
(4)如图1表示某同学配制480mL 0.5mol/L 的NaOH溶液的部分操作示意图,其中有错误的是___________,这样操作所配制的溶液比要求的浓度要___________ (填“偏高”、“偏低”、“不影响”)。配制应称取___________gNaOH。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】发展“绿色食品”是提高人类生存质量的重要措施,绿色食品指( )
A.绿颜色的营养食品 B.含叶绿素的营养食品
C.植物类营养食品 D.安全无公害的营养食品
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上一般在恒容密闭容器中可以采用下列反应合成甲醇:CO(g)+2H2(g) ![]() CH3OH(g) ΔH
CH3OH(g) ΔH
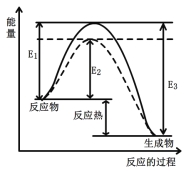

图1 (图中表示生成1mol物质时的能量) 图2
(1)根据图1请写出合成甲醇的热化学方程式 (热量用E1、E2或E3表示)。
(2)该反应的逆反应速率随时间变化的关系如上图2。t1时改变了某种条件,改变的条件可能是 。
(3)判断反应达到平衡状态的依据是 (填字母序号)。
A.2v(H2)(逆) =v(CO)(正)
B.混合气体的密度不变
C.混合气体的平均相对分子质量不变
D.CH3OH、CO、H2的浓度都不再发生变化
E.容器内CO、H2、CH3OH的浓度之比为1:2:1
(4)在一定温度下,若将4a mol H2和2amol CO放入2L的密闭容器中,充分反应后测得CO的转化率为50%,则该反应的平衡常数为 。若此时再向该容器中投入a mol CO、2amol H2和amol CH3OH,判断平衡移动的方向是 _______(“正向移动”“逆向移动”或“不移动”);与原平衡相比,CO的物质的量浓度 _____(填“增大”、“不变”或“减小”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼酸(H3BO3)大量应用于玻璃制造业,以硼镁矿(2MgO·B2O3·H2O、SiO2及少量Fe3O4、CaCO3, Al2O3)为原料生产硼酸的工艺流程如下:

已知:ⅰ.Fe3+、Al3+、Fe2+和Mg2+以氢氧化物形式完全沉淀时,溶液的pH分别为3.2、5.2、9.7和12.4。
ⅱ.H3BO3在20℃、40℃、60℃、100℃时的溶解度依次为5.0g、8.7g、14.8g、40.2g。
(1)为了提高硼镁矿粉的浸出率,可采取的措施有 (至少答两条)
(2)“浸出液”显酸性,含H3BO3和Mg2+和SO42-,还含有Fe2+、Fe3+、Ca2+、Al3+等杂质。“除杂”时向浸出液中依次加入适量H2O2和MgO, H2O2的作用是 (用离子方程式表示),MgO除去的杂质离子是 。
(3)已知H3BO3与过量的NaOH反应生成Na[B(OH)4],试写出H3BO3在溶液中的电离方程式 。
(4)“浸取”后,采用“热过滤”的目的是 ,母液中的主要溶质有 。
(5)“母液”可用于回收硫酸镁,已知硫酸镁的溶解度随温度变化的曲线如下图,且溶液的沸点随压强增大而升高。为了从“母液”中充分回收MgSO4·H2O,应采取的 措施是将“母液”蒸发浓缩,____________
(6)测定所得产品的纯度:取ag 硼酸,小心加热使其分解脱去水分(杂质受热不分解),得残留固体bg,则产品的纯度为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下列反应中,HCl作还原剂的是( )
A. NaOH + HCl = NaCl + H2O
B. Zn + 2HCl = ZnCl2 + H2↑
C. MnO2 + 4HCl(浓)![]() MnCl2 + 2H2O + Cl2↑
MnCl2 + 2H2O + Cl2↑
D. CuO + 2HCl = CuCl2 + H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物J具有抗缺血性脑损伤的作用,合成J的一种路线如下:

已知:①
②E的核磁共振氢谱只有一组峰
③C能发生银镜反应
回答下列问题:
(1)D所含有官能团的名称 。
(2)由D生成E的化学方程式为 ,其反应类型为
(3)G的结构简式为 。
(4)C的某同系物X,相对分子质量比C大14,X的结构有 种,其中核磁共振氢谱为4组峰,且锋面面积比为1:2:2:2的是 (写结构简式)。
(5)由甲醛和化合物A经下列步骤可得到2-苯基乙醇。
![]()
反应条件1为 ;反应条件2所选择的试剂为 ;L的结构简式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组的同学为探究二氧化硫的化学性质,设计了如下图所示的装置。请回答下列问题。

(1)铜和浓硫酸反应中浓硫酸的作用为______________。
(2)B 瓶中盛有品红溶液,观察到品红溶液褪色,这是因为SO2具有_______,C 瓶中盛有新制的氯水,观察到氯水褪色,这是因为SO2具有_________。
A.氧化性 B.还原性 C.漂白性
(3)D瓶中盛有足量NaOH溶液以除去SO2,该反应的主要产物的化学式为________。
(4)充分反应后,小组同学发现铜和硫酸都有剩余。若想使剩余的铜片溶解,可再加入____________
A .HNO3 B .NaNO3 C.NaHCO3 D.Na2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
在实验室中模拟工业制取NaHCO3的实验步骤如下:
第一步:连接好装置,检验气密性,在仪器内装入药品。
第二步:先让某一装置发生反应,直到产生的气体不能再在C中溶解,再通入另一装置中产生的气体,片刻后,C中出现固体。继续向C中通入两种气体,直到不再有固体产生。
第三步:分离C中所得的混合物,得到NaHCO3固体。
第四步:向滤液中加入适量的某固体粉末,有NH4Cl晶体析出。
(1)下图所示装置的连接顺序是:a接________;________接_______;b接_________(填接口编号)。

(2)A中常选用的固体反应物为_______________;D中应选用的液体为________________。
(3)第二步中让___________装置先发生反应。
(4)C中用球形干燥管而不用直导管,其作用是______________________;装有无水CaCl2的U形管的作用是_________________________。
(5)第三步分离出NaHCO3固体的操作是________________。
(6)第四步中所加固体粉末化学式为 。所得的晶体中常含有少量的NaCl和NaHCO3(约占5%~8%),请设计一个简单的实验,不使用其他任何试剂,证明所得晶体大部分是NH4C1。简要写出操作和现象_____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com