
| 初始pH | pH=2.5 | pH=4.5 |
| 1小时pH | 接近中性 | 接近中性 |
| 24小时pHNO3-的去除率 | 接近100% | <50% |
| 铁的最终物质形态 | 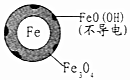 | 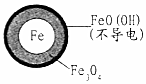 |
分析 (1)①Fe还原水体中NO3-,根据题意Fe3O4为电解质,则Fe作还原剂,失去电子,作负极;
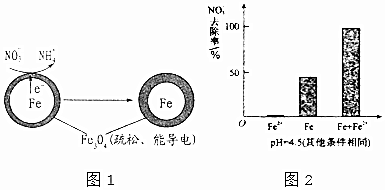
②NO3-在正极得电子发生还原反应产生NH4+,根据图2信息可知为酸性环境;
(2)pH越高,Fe3+越易水解生成FeO(OH);
(3)由图可知,只投入亚铁离子硝酸根离子的去除率接近为0,所以亚铁离子与硝酸根离子不反应,而在Fe和Fe2+共同作用下能提高NO3-的去除率;Fe2+将不导电的FeO(OH)转化为可导电的Fe3O4,初始pH低时,产生的Fe2+充足;初始pH高时,产生的Fe2+不足;
(4)可以通过改颗粒的大小,来加快化学反应的速率.
解答 解:(1)①Fe还原水体中NO3-,则Fe作还原剂,失去电子,作负极,
故答案为:铁;
②NO3-在正极得电子发生还原反应产生NH4+,根据图2信息可知为酸性环境,则正极的电极反应式为:NO3-+8e-+10H+=NH4++3H2O,
故答案为:NO3-+8e-+10H+=NH4++3H2O;
(2)pH越高,Fe3+越易水解生成FeO(OH),而FeO(OH)不导电,阻碍电子转移,所以NO3-的去除率低,发生离子方程式为:Fe3++2H2O?FeO(OH)+3H+,故答案为:FeO(OH)不导电,阻碍电子转移;
(3)由图可知,只投入亚铁离子硝酸根离子的去除率接近为0,所以亚铁离子与硝酸根离子不反应,而在Fe和Fe2+共同作用下能提高NO3-的去除率;Fe2+将不导电的FeO(OH)转化为可导电的Fe3O4,初始pH低时,产生的Fe2+充足;初始pH高时,产生的Fe2+不足,
故答案为:本实验条件下,Fe2+不能直接还原NO3-,在Fe和Fe2+共同作用下能提高NO3-的去除率; Fe2+将不导电的FeO(OH)转化为可导电的Fe3O4;初始pH低时,产生的Fe2+充足;初始pH高时,产生的Fe2+不足;
(4)可以通过改颗粒的大小,减小铁粉的颗粒大小,增大反应接触面积或加入活性炭,形成微电池,故答案为:减小铁粉的颗粒大小,增大反应接触面积或加入活性炭,形成微电池.
点评 本题主要考查化学反应原理,涉及电化学、氧化还原反应等相关知识,题中的Fe与NO3-的反应跟溶液酸碱性有关,抓住这一点是解题的关键,难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 生成物总能量一定低于反应物总能量 | |
| B. | 放热反应的反应速率总是大于吸热反应的反应速率 | |
| C. | 键能越大,物质越稳定,断键所需的能量就越大 | |
| D. | 同温同压下,H2(g)+Cl2(g)═2HCl(g)在光照和点燃条件下的所放出的热量不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化合物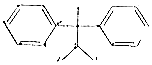 是苯的同系物 是苯的同系物 | |
| B. | 有机物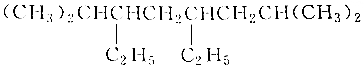 的系统名称是2-甲基-4-乙基-6-异丙基辛烷 的系统名称是2-甲基-4-乙基-6-异丙基辛烷 | |
| C. | C4H8的同分异构体只有3种 | |
| D. | 液化石油气的主要成分是烃,它是一种清洁燃料 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
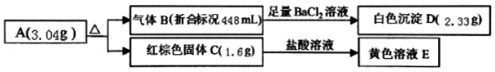
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 古代利用明矾溶液的酸性清除铜镜表面的铜锈 | |
| B. | Ba2+对人体无毒,故BaSO4在医学上可用作钡餐 | |
| C. | 侯氏制碱法工业过程中应用了物质溶解度的差异 | |
| D. | “煤改气”、“煤改电”等工程有利于减少雾霾 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
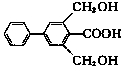 )的说法正确的是.
)的说法正确的是.| A. | 分子式为C15H19O4 | |
| B. | 苯环上的一氯代物有7种 | |
| C. | 能发生氧化反应和取代反应 | |
| D. | 1molX与足量的NaOH溶液反应,最多消耗3molNaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向 H2O中通人 NO2:3NO2+H2O═H++NO3-+2NO | |
| B. | 向Na2SiO3溶液中通入少量SO2:Na2SiO3+SO2+H2O═H2SiO3↓+2Na++SO32- | |
| C. | 用饱和纯減溶液洗涤试管中残留的苯酚:CO32-+2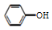 →2 →2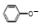 +CO2↑+H2O +CO2↑+H2O | |
| D. | 等体积等物质的量浓度的NH4Fe(SO4)2和Ba(OH)2混合:2Fe3++3SO42-+3Ba2++6OH-═3BaSO4↓+2Fe(OH)3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 选项 | 实验操作和现象 | 结论 |
| A | 在酒精灯上加热铝箔,铝箔熔化但不滴落 | 熔点:铝>氧化铝 |
| B | 向某溶液中先滴加KSCN溶液,再滴加少量氯水,先无明显现象,后溶液变成血红色 | 原溶液中含有Fe3+,没有Fe2- |
| C | KNO3和KOH混合溶液中加入铝粉并加热,管口放湿润的红色石蕊试纸,试纸变为蓝色 | NO3-还原为NH3 |
| D | 向加入了几滴酚酞试液的Na2CO3溶液中滴加BaCl2溶液,红色逐渐褪去 | Na2CO3溶液中存在水解平衡 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com