
【题目】工业甲醇的质量分数可以用下列方法测定:
①在稀H2SO4中甲醇被Cr2O72-氧化成CO2和H2O,反应式为:CH3OH+Cr2O72-+8H+=CO2↑+2Cr3++6H2O;
②过量的Cr2O72-可用Fe2+与之完全反应:
Cr2O72﹣+ Fe2++ H+- Cr3++ Fe3++ H2O
现有0.12g工业甲醇,在H2SO4溶液中与25mL0.2molL-1K2Cr2O7溶液反应,多余的K2Cr2O7再用1molL-1FeSO4与其反应,结果用去FeSO4溶液9.6mL。
(1)配平第②步中离子方程式___。
(2)计算工业甲醇的质量分数___。
【答案】Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O 90.7%
【解析】
(1)依据化学反应的元素化合价变化结合电子守恒计算配平离子方程式,电子转移:Cr2O72-~2Cr3+~6e-;6Fe2+~6Fe3+~6e-;所以配平氧化还原反应的电子守恒,结合电荷守恒和原子守恒得到配平系数:1、6、14、2、6、7,配平后的离子方程式为:Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O;
(2)9.6mL1.0mol/LFeSO4溶液中含有亚铁离子的物质的量为:1.0mol/L×0.0096L=0.0096mol,由反应②可知,反应①剩余的n(Cr2O72-)=![]() n(Fe2+)=0.0016mol,25.0mL0.2mol/LK2Cr2O7溶液中含有重铬酸根离子的物质的量为:0.2mol/L×0.025L=0.0050mol,则反应①消耗的n(Cr2O72-)=0.0050mol-0.0016mol=0.0034mol,则:n(CH3OH)=0.0034mol,w(CH3OH)=
n(Fe2+)=0.0016mol,25.0mL0.2mol/LK2Cr2O7溶液中含有重铬酸根离子的物质的量为:0.2mol/L×0.025L=0.0050mol,则反应①消耗的n(Cr2O72-)=0.0050mol-0.0016mol=0.0034mol,则:n(CH3OH)=0.0034mol,w(CH3OH)=![]() ×100%=90.7%。
×100%=90.7%。


科目:高中化学 来源: 题型:
【题目】有A、B、C、D、E、F六种主族元素,已知:(a)A原子有四个电子层,其K、L层电子数分别与N、M层电子数相等;(b)B、C原子核外电子层数比A原子少1,B的最高正价和最低负价的代数和等于零,C的简单气态氢化物的化学式是H2C;(c)D、E的阴离子都带有一个单位的负电荷,D的阴离子的电子层结构与氩原子相同,E元素没有对应的含氧酸;(d)F与A位于同一周期且是六种元素中原子半径最大的元素。
(1)写出六种元素的名称:A___;B___;C___;D___;E___;F___。
(2)A、C、D、F四种元素的简单离子的半径由大到小的顺序为____(用离子符号表示)。
(3)B、C、D三种元素的简单气态氢化物的稳定性由强到弱的顺序为___(用化学式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组为探究元素性质的递变规律,设计以下实验。
Ⅰ.(1)将钠、钾、镁、铝各1![]() 分别投入足量的0.1
分别投入足量的0.1![]() 的盐酸中,试预测实验结果:______与盐酸反应最剧烈,______与盐酸反应最慢。
的盐酸中,试预测实验结果:______与盐酸反应最剧烈,______与盐酸反应最慢。
(2)将![]() 溶液与
溶液与![]() 溶液混合生成
溶液混合生成![]() ,从而验证
,从而验证![]() 的碱性强于
的碱性强于![]() ,继而可以验证
,继而可以验证![]() 的金属性强于
的金属性强于![]() 。此设计______(填“合理”或“不合理”),理由是________________________。
。此设计______(填“合理”或“不合理”),理由是________________________。
Ⅱ.利用如图所示装置可以验证非金属性的变化规律。

(3)仪器![]() 的名称为____________,干燥管
的名称为____________,干燥管![]() 的作用是__________________。
的作用是__________________。
(4)实验室中现有药品:![]() 溶液、
溶液、![]() 浓盐酸、
浓盐酸、![]() ,请选择合适的药品设计实验来验证氯的非金属性强于硫。装置
,请选择合适的药品设计实验来验证氯的非金属性强于硫。装置![]() 、
、![]() 、
、![]() 中所装药品分别为____________、____________、____________,装置
中所装药品分别为____________、____________、____________,装置![]() 中的实验现象为有黄色沉淀生成,相关反应的离子方程式为______________________________________。
中的实验现象为有黄色沉淀生成,相关反应的离子方程式为______________________________________。
(5)若要证明非金属性:![]() ,则
,则![]() 中加__________,
中加__________,![]() 中加
中加![]() ,
,![]() 中加__________,观察到
中加__________,观察到![]() 中的现象为______________________________。
中的现象为______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“封管实验”具有简易、方便、节约、绿色等优点,下列关于三个“封管实验”(夹持装置未画出)的说法正确的是( )
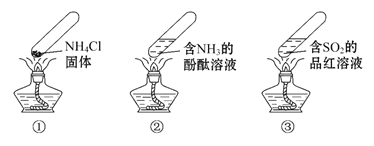
A. 加热时,①中上部汇集了NH4Cl固体
B. 加热时,②中溶液变红,冷却后又都变为无色
C. 加热时,③中溶液红色褪去,冷却后溶液变红,体现SO2的漂白性
D. 三个“封管实验”中所发生的化学反应都是可逆反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)FeS2(二硫化亚铁)不溶于水,可溶于适量的稀硝酸中,离子反应式如下,请配平此氧化还原反应方程式:_____FeS2+_____H++_____N![]() =______Fe2++______S+_____NO↑+______H2O。在上述氧化还原反应方程式中还原剂为_____________。
=______Fe2++______S+_____NO↑+______H2O。在上述氧化还原反应方程式中还原剂为_____________。
(2)为了验证Fe3+的性质,某化学兴趣小组设计了如图所示的一组实验,实验方案设计错误的是____________(填字母)

A.④和⑤ B.只有③ C.③和④ D.①②③
(3)已知:氧化性Cl2>Br2>Fe3+,还原性Fe2+>Br->Cl-,则向1 L 0.2 mol·L-1的FeBr2溶液中通入标准状况下氯气2.24 L,被氧化的粒子是________,此反应的离子方程式:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如图所示装置(熔融CaF2-CaO作电解质)获得金属钙,并用钙还原TiO2制备金属钛。下列说法正确的是

A. 电解过程中,Ca2+向阳极移动
B. 阳极的电极反应式为: C+2O2--4e-=CO2↑
C. 在制备金属钛前后,整套装置中CaO的总量减少
D. 若用铅蓄电池作该装置的供电电源,“+”接线柱连接的是Pb电极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在a L Fe2(SO4)3和CuSO4的混合溶液中加入b mol BaCl2,恰好使溶液中的SO42完全沉淀;如加入足量的NaOH溶液得沉淀c mol,则原溶液中的c(Fe3+)为( )
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式正确的是( )
A.FeCl3溶液腐蚀铜线路板:Fe3++Cu=Fe2++Cu2+
B.氯气通入水中:Cl2+H2O=2H++ClO-+Cl-
C.金属铝加入到NaOH溶液中:2Al+2OH-+2H2O=2AlO2-+3H2↑
D.Na2O加入稀硫酸中:O2-+2H+=H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知伞形酮可用雷琐苯乙酮和苹果酸在一定条件下反应制得
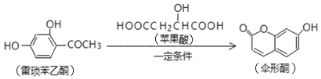
下列说法中正确的是( )
A.一分子反应物雷琐苯乙酮含有3个碳碳双键
B.苹果酸的一种缩聚产物是![]()
C.1mol产物伞形酮与足量NaOH溶液反应,最多可消耗2molNaOH
D.反应中涉及到的三种有机物都能跟FeCl3溶液发生显色反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com