
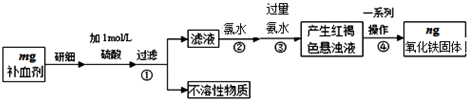
分析 由流程图可知,该实验原理为:将药品中的Fe2+形成溶液,将Fe2+氧化为Fe3+,使Fe3+转化为氢氧化铁沉淀,再转化为氧化铁,通过测定氧化铁的质量,计算补血剂中铁元素的含量.
(1)用量筒量取浓硫酸体积,在烧杯中稀释,并用玻璃棒搅拌,冷却后引入500mL容量瓶中,洗涤、加水定容,距离刻度线1-2cm改用胶头滴管;
(2)加入过量的氯水将Fe2+完全氧化为Fe3+;
(3)步骤④中一系列处理是由氢氧化铁悬浊液最终转化为氧化铁,需要过滤、洗涤的氢氧化铁,然后灼烧生成氧化铁,冷却后称量氧化铁的质量;
(4)由Fe元素守恒,根据氧化铁的质量计算铁元素的质量分数;
(5)A.步骤③所加氨水量不足,铁离子不能完全转化为氢氧化铁沉淀;
B.步骤④洗涤不充分,氢氧化铁会附着杂质;
C.步骤④灼烧不充分,氢氧化铁分解不完全,测定氧化铁的质量偏大.
(6)补血剂本质时Fe2+被氧化为Fe3+,Fe3+遇KSCN溶液显红色,该现象用于检验Fe3+存在.
解答 解:由流程图可知,该实验原理为:将药品中的Fe2+形成溶液,将Fe2+氧化为Fe3+,使Fe3+转化为氢氧化铁沉淀,再转化为氧化铁,通过测定氧化铁的质量,计算补血剂中铁元素的含量.
(1)用量筒量取浓硫酸体积,在烧杯中稀释,并用玻璃棒搅拌,冷却后引入500mL容量瓶中,洗涤、加水定容,距离刻度线1-2cm改用胶头滴管,配制时用到的仪器除烧杯、玻璃棒外,还有两种仪器是:500mL容量瓶、胶头滴管,
故答案为:500mL容量瓶、胶头滴管;
(2)加入过量的氯水将Fe2+完全氧化为Fe3+,反应离子方程式为:2Fe2++Cl2=2Fe3++2Cl-,
故答案为:将Fe2+全部氧化为Fe3+;2Fe2++Cl2=2Fe3++2Cl-;
(3)步骤④中一系列处理是由氢氧化铁悬浊液最终转化为氧化铁,需要过滤、洗涤的氢氧化铁,然后灼烧生成氧化铁,冷却后称量氧化铁的质量,
故答案为:洗涤;
(4)最后氧化铁为ag,氧化铁含有铁元素的质量为$\frac{112}{160}$×n g=0.7n g,故补血剂含铁元素的质量分数为$\frac{0.7ng}{mg}$×100%=$\frac{70n}{m}$%,
故答案为:$\frac{70n}{m}$%;
(5)A.步骤③所加氨水量不足,铁离子不能完全转化为氢氧化铁沉淀,测定氧化铁的质量偏小,故铁元素质量分数偏小,故A不符合;
B.步骤④洗涤不充分,氢氧化铁会附着杂质,测定氧化铁的质量偏大,故铁元素质量分数偏高,故B符合;
C.步骤④灼烧不充分,氢氧化铁分解不完全,测定氧化铁的质量偏大,故铁元素质量分数偏高,故C符合,
故选:BC;
(6)补血剂本质时Fe2+被氧化为Fe3+,过滤后取滤液加KSCN溶液,若溶液变成红色,说明该补血剂已变质.
故答案为:KSCN;红.
点评 本题考查物质含量探究实验,设计对实验原理与实验操作的理解、物质分离提纯、元素化合物性质、化学计算等,难度中等,清楚实验原理是解题的关键,需要学生具备扎实的基础知识与综合运用知识分析问题、解决问题的能力.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素 | 有关信息 |
| A | 最高价氧化物对应的水化物与其氢化物反应生成离子化合物 |
| B | 地壳中含量最多的元素 |
| C | 单质须保存在煤油中 |
| D | 单质与NaOH溶液反应可用于生产漂白液 |
| E | 单质是生活中用量最大的金属,其制品在潮湿空气中易被腐蚀或损坏 |
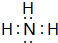 ,其最高价氧化物对应的水化物与其氢化物反应的离子方程式:NH3+H+=NH4+.
,其最高价氧化物对应的水化物与其氢化物反应的离子方程式:NH3+H+=NH4+. 查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 滴定终点读数时俯视读数 | |
| B. | 锥形瓶洗净后未干燥 | |
| C. | 碱式滴定管滴定前尖嘴部分有气泡,滴定后气泡消失 | |
| D. | 酸式滴定管使用前,水洗后未用待测盐酸润洗 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3CH2CH2CH2CH3 | B. | 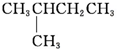 | C. |  | D. | 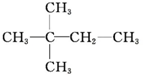 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
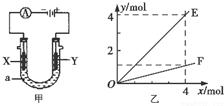
| A. | 若此装置用于电解精炼铜,则X为纯铜、Y为粗铜,电解的溶液a可以是硫酸铜或氯化铜溶液 | |
| B. | 按图甲装置用惰性电极电解AgN03溶液,若图乙横坐标x表示流入电极的电子的物质的量,则E可表示反应生成硝酸的物质的量,F表示电解生成气体的物质的量 | |
| C. | 按图甲装置用惰性电极电解一定浓度的硫酸铜溶液,通电一段时间后,加入0.5mol的碳酸铜刚好恢复到通电前的浓度和pH,则电解过程中转移的电子为2.0 mol | |
| D. | 若X、Y为铂电极.a溶液为500 mL KCl和KNO3的混合液,经过一段时间后,两极均得到标准状况下11.2 L气体,则原混合液中KCl的物质的量浓度至少为2.0 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 苯甲酸(无色针状晶体,熔点122.4℃)可广泛用于医药、染料载体、香料等,实验室用甲苯和高锰酸钾制备苯甲酸.反应方程式如下:
苯甲酸(无色针状晶体,熔点122.4℃)可广泛用于医药、染料载体、香料等,实验室用甲苯和高锰酸钾制备苯甲酸.反应方程式如下: +2KMnO4 $\stackrel{△}{→}$
+2KMnO4 $\stackrel{△}{→}$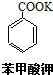 +KOH+2MnO2↓+H2O
+KOH+2MnO2↓+H2O 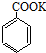 +HCl→
+HCl→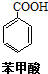 +KCl
+KCl| 化合物 | 相对分子质量 | 密度(g•cm-3) | 溶解性 | 沸点(℃) |
| 甲苯 | 92 | 0.87 | 难溶于水 | 110.0 |
| 苯甲酸钾 | 160 | - | 易溶于水 | - |
| 苯甲酸 | 122 | 1.26 | 微溶于水 | 248.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com