
| A. | $\frac{14M}{{a}^{3}{N}_{A}}$ | B. | $\frac{M}{{a}^{3}{N}_{A}}$ | C. | $\frac{2M}{{a}^{3}{N}_{A}}$ | D. | $\frac{4M}{{a}^{3}{N}_{A}}$ |
分析 干冰晶体为面心结构,每个顶点上的二氧化碳分子被8个晶胞共用,每个面心上的二氧化碳分子被两个晶胞共用,所以该晶胞中二氧化碳分子个数=8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,根据ρ=$\frac{m}{V}$=$\frac{\frac{M}{{N}_{A}}×4}{V}$计算出该干冰晶体的密度.
解答 解:干冰晶胞是面心立方晶胞,所以每个晶胞中含有二氧化碳分子个数=8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,晶胞边长为acm,则体积为a3cm3,则该干冰晶胞密度为:ρ=$\frac{m}{V}$=$\frac{\frac{M}{{N}_{A}}×4}{V}$=$\frac{\frac{M}{{N}_{A}}×4}{{a}^{3}}$g/cm3=$\frac{4M}{{a}^{3}{N}_{A}}$g/cm3,
故选D.
点评 本题考查了晶胞的计算,利用均摊法计算晶胞中含有的二氧化碳分子个数,再根据密度公式计算其密度即可,难度中等.


科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作及现象 | 实验结论 |
| A | 向某溶液中加入氯化钡溶液,有白色沉淀生成,再加盐酸酸化,沉淀不溶解 | 该溶液中一定含有SO42- |
| B | 浓硫酸滴入蔗糖中,搅拌得黑色蓬松的固体并有刺激性气味 | 该过程中浓硫酸仅体现吸水性和脱水性 |
| C | 在酒精灯上加热铝箔,铝箔熔化,但不滴落,好像有一层膜兜着 | 铝易被氧化;铝的熔点比氧化铝低 |
| D | 向某溶液中加入稀盐酸,产生能使澄清石灰水变浑浊的无色气体 | 该溶液中一定含有CO32- |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

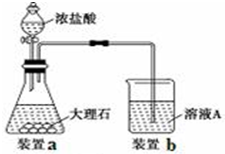

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验混合溶液 | A | B | C | D | E | F |
| 4mol/LH2SO4/mL | 30 | V1 | V2 | V3 | V4 | V5 |
| 饱和CuSO4溶液/mL | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
| H2O/mL | V7 | V8 | V9 | V10 | 10 | 0 |

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 控制含磷洗涤剂的生产和使用,防止水体富营养化,保护水资源 | |
| B. | 开发太阳能、水能、风能、可燃冰等新能源,减少使用煤、石油等化石燃料 | |
| C. | 研究采煤、采油新技术,尽量提高产量以满足工业生产的快速发展 | |
| D. | 实现资源的“3R”利用,即:减少资源消耗(Reduce)、增加资源的重复使用(Reuse)、资源的循环再生(Recycle) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com