
【题目】有效去除大气中的H2S、SO2以及废水中的硫化物是环境保护的重要课题。
(1)去除废气中H2S的相关热化学方程式如下:
2H2S(g)+3O2(g)=2H2O(l)+2SO2(g);ΔH=akJ·mol-1
2H2S(g)+SO2(g)=2H2O(l)+3S(s);ΔH=bkJ·mol-1
反应2H2S(g)+O2(g)=2H2O(l)+2S(s)的ΔH=__kJ·mol-1。
为了有效去除废气中的H2S,在燃烧炉中通入的H2S和空气(O2的体积分数约为20%)体积比一般控制在0.4,理由是__。
(2)电化学氧化法是一种高效去除废水中硫化物的方法,电解NaHS溶液脱硫的原理如图1所示。碱性条件下,HS-首先被氧化生成中间产物Sn2-,S n2-容易被继续氧化而生成硫单质。
①阳极HS-氧化为S n2-的电极反应式为___。
②电解一段时间后,阳极的石墨电极会出现电极钝化,导致电极反应不能够持续有效进行,其原因是___。

(3)用CO(NH2)2(N为-3价)水溶液吸收SO2,吸收过程中生成(NH4)2SO4和CO2。该反应中的氧化剂是__。
(4)在一定条件下,CO可以去除烟气中的SO2,其反应原理为2CO+SO2=2CO2+S。其他条件相同、以比表面积大的γ—Al2O3作为催化剂,研究表明,γ—Al2O3在240℃以上发挥催化作用。反应相同的时间,SO2的去除率随反应温度的变化如图2所示。240℃以前,随着温度的升高,SO2去除率降低的原因是__。240℃以后,随着温度的升高,SO2去除率迅速增大的主要原因是__。

【答案】![]() 如果H2S和空气体积比大于0.4,废气中H2S脱除效率低 nHS--2(n-1)e-+nOH=Sn2-+nH2O 阳极产生的硫覆盖在石墨电极表面,导致石墨电极导电性下降 O2 温度较低时,SO2能够被催化剂吸附。温度升高,吸附能力减弱 温度较高时,SO2在催化剂存在条件下被CO还原。温度升高,催化剂活性增强,反应速率加快
如果H2S和空气体积比大于0.4,废气中H2S脱除效率低 nHS--2(n-1)e-+nOH=Sn2-+nH2O 阳极产生的硫覆盖在石墨电极表面,导致石墨电极导电性下降 O2 温度较低时,SO2能够被催化剂吸附。温度升高,吸附能力减弱 温度较高时,SO2在催化剂存在条件下被CO还原。温度升高,催化剂活性增强,反应速率加快
【解析】
(1)设2H2S(g)+3O2(g)=2H2O(l)+2SO2(g)为①式,2H2S(g)+SO2(g)=2H2O(l)+3S(s)为②式,根据盖斯定律,目标方程式为![]() ,故ΔH=
,故ΔH=![]() kJ·mol-1;根据2H2S(g)+O2(g)=2H2O(l)+2S(s)可知, H2S与O2的比例为2:1,空气中O2占20%,故H2S与空气之比为2:5(即0.4)时可以完全反应。若大于0.4,H2S会有剩余,脱除效率低;
kJ·mol-1;根据2H2S(g)+O2(g)=2H2O(l)+2S(s)可知, H2S与O2的比例为2:1,空气中O2占20%,故H2S与空气之比为2:5(即0.4)时可以完全反应。若大于0.4,H2S会有剩余,脱除效率低;
(2)①阳极HS-失电子变成阳极HS-:nHS--2(n-1)e-+nOH=Sn2-+nH2O;
②阳极生成的Sn2-容易被继续氧化而生成硫单质,硫单质不导电,覆盖在石墨电极表面,导致石墨电极导电性下降;
(3)CO(NH2)2水溶液吸收SO2,生成(NH4)2SO4和CO2,S由+4价升为+6价,而C(+4价)、N(-3价)、H(+1价)都没有变价,所以氧化剂只能是O2;
(4)催化剂γ—Al2O3的比表面积大,具有吸附性,温度较低时(小于240℃),SO2能够被催化剂吸附,SO2含量降低,随着温度的升高催化剂的吸附能力减弱,导致催化剂吸附的SO2减少;
温度较高(大于240℃)时,发生反应2CO+SO2=2CO2+S ,SO2在催化剂存在条件下被CO还原。温度升高,催化剂活性增强,反应速率加快,SO2去除率增大;


 阳光课堂课时优化作业系列答案
阳光课堂课时优化作业系列答案科目:高中化学 来源: 题型:
【题目】如图是中学化学中常用于混合物的分离和提纯的装置,请根据装置回答问题:

(1)除去自来水中的Ca2+、Mg2+、Cl-、SO42-等杂质,选择装置___(填代表装置图的字母)。
(2)用CCl4萃取碘水中的I2,有机层的颜色为___。
(3)装置A中①的名称是___,进水的方向是___,装置B在分液时为使液体顺利滴下,应进行的具体操作是___。
(4)海水中蕴藏着丰富的资源。在实验室中取少量海水,进行如下流程的实验: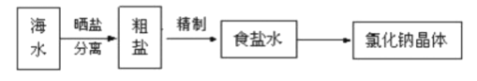
问题:粗盐中含Ca2+、Mg2+、Fe3+、SO42-等杂质,需要提纯后才能综合利用。粗盐提纯的步骤有:①加入过量的Na2CO3溶液;②加入过量的BaCl2溶液;③加入过量的NaOH溶液④调节溶液的pH等于7:⑤溶解;⑥过滤;⑦蒸发。
正确的操作顺序是___(填写字母)。
a.⑤②③①⑥④⑦ b.⑤①②③⑥④⑦ c.⑤③②①⑥④⑦ d.⑤②①③⑥④⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】100mL 0.3mol/L Na2SO4溶液和50mL0.2mol/L Al2(SO4)3溶液混合后,溶液中SO42-的物质的量浓度约为(不考虑混合后溶液体积的变化)
A.0.20mol/LB.0.25mol/LC.0.40mol/LD.0.50mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把13g Zn放入足量的盐酸中,Zn完全反应。计算:
(1)13g Zn的物质的量___________
(2)参加反应的HCl的物质的量___________
(3)生成H2的体积(标准状况)___________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知铜在常温下能被稀硝酸溶解,其反应的化学方程式如下:
3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O
(1)被氧化的元素是________,被还原的元素是______。
(2)发生氧化反应的物质是__________,发生还原反应的物质是__________。
(3)用双线桥法表示反应电子得失的方向和数目__________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列选项中离子能大量共存的是( )
(1)与铝粉反应放出H2的无色溶液:NO3-、Al3+、Na+、SO42-
(2)含有大量NO3-的溶液:H+、Fe2+、Cl-、SO42-
(3)中性溶液:Fe3+、Al3+、NO3-、SO42-
(4)使pH试纸显蓝色的溶液:Cu2+、NO3-、Fe3+、SO42-
(5)含有大量Fe3+的溶液:Na+、SCN-、Cl-、I-
(6)常温下![]() =1×10-12的溶液:K+、AlO2-、CO32-、Na+
=1×10-12的溶液:K+、AlO2-、CO32-、Na+
(7)c(H+)=0.1 mol·L-1的溶液:Na+、NH4+、SO42-、S2O32-
A.(3)(6)B.(2)(3)(6)C.(6)D.(2)(6)(7)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E五种化合物均含有某种短周期常见元素,它们的转化关系如图所示,其中A的溶液为澄清溶液,C为难溶的白色固体,E易溶于水,取A的溶液灼烧,焰色反应为浅紫色(透过蓝色钴玻璃)。

(1)写出化学式:A_______,B_______,C_______,D_______,E_______。
(2)写出下列反应的离子方程式:
A→B:_________________________________________________________;
A→D:__________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实不能用化学平衡移动原理解释的是
A.收集氯气可以用排饱和食盐水的方法
B.在一定条件下,氢气与碘蒸汽反应达平衡后,加压,混合气体颜色变深
C.可用浓氨水和氢氧化钠固体快速制取氨气
D.合成三氧化硫过程中使用过量的氧气,以提高二氧化硫的转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对化学用语的理解正确的是( )
A.键线式H-C1-O可以表示次氯酸分子的结构
B.电子式![]() 可以表示氢氧根离子,也可以表示羟基
可以表示氢氧根离子,也可以表示羟基
C.结构示意图 可以可以表示35Cl-,也可以表示37Cl-
可以可以表示35Cl-,也可以表示37Cl-
D.比例模型![]() 可以表示甲烷分子,也可以表示四氯化碳分子
可以表示甲烷分子,也可以表示四氯化碳分子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com