
【题目】已知:CH3—CH=CH2+HBr→CH3—CHBr—CH3(主要产物),1 mol某烃A充分燃烧后可以得到8 mol CO2和4 mol H2O。该烃A在不同条件下能发生如下面所示的一系列变化。
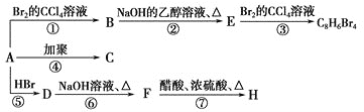
(1)A的化学式:________,A的结构简式________。
(2)上述反应中,①是________反应,⑦是________反应。(填反应类型)
(3)写出C,D,E,H物质的结构简式:
C_________,D_________,E_______,H________。
(4)写出DF反应的化学方程式_____________________。
【答案】C8H8 ![]() 加成 酯化(取代)
加成 酯化(取代) 
![]()
![]()
![]()
 +NaOH
+NaOH
【解析】
1mol某烃A充分燃烧后可以得到8molCO2和4molH2O,故烃A的分子式为C8H8,不饱和度为![]() =5,可能含有苯环,由A发生加聚反应生成C,故A中含有不饱和键,故A为
=5,可能含有苯环,由A发生加聚反应生成C,故A中含有不饱和键,故A为![]() ,C为
,C为 ,A与溴发生加成反应生成B,则B为
,A与溴发生加成反应生成B,则B为 ,B在氢氧化钠的乙醇溶液、加热条件下发生消去反应生成E,则E为
,B在氢氧化钠的乙醇溶液、加热条件下发生消去反应生成E,则E为![]() ,E与溴发生加成反应生成
,E与溴发生加成反应生成![]() ,由信息烯烃与HBr的加成反应可知,不对称烯烃与HBr发生加成反应,H原子连接在含有H原子多的C原子上,故
,由信息烯烃与HBr的加成反应可知,不对称烯烃与HBr发生加成反应,H原子连接在含有H原子多的C原子上,故![]() 与HBr放出加成反应生成D,则D为
与HBr放出加成反应生成D,则D为![]() ,D在氢氧化钠水溶液、加热条件下发生水解反应生成F,则F为
,D在氢氧化钠水溶液、加热条件下发生水解反应生成F,则F为![]() ,F与乙酸发生酯化反应生成H,故H为
,F与乙酸发生酯化反应生成H,故H为![]() ,据此解答。
,据此解答。
根据上述分析,
(1)由上述分析可知,A的分子式为C8H8,A的结构简式:![]() ,故答案为:C8H8;
,故答案为:C8H8;![]() ;
;
(2)上述反应中,反应①是![]() 与溴发生加成反应生成
与溴发生加成反应生成 ,
,
反应⑦是F![]() 与乙酸发生酯化反应生成H
与乙酸发生酯化反应生成H![]() ,
,
故答案为:加成;酯化(取代);
(3)由上述分析可知,C为 ,D为
,D为![]() ,E为
,E为![]() ,H为
,H为![]() ,
,
故答案为: ;
;![]() ;
;![]() ;
;![]() ;
;
(4)D![]() F是
F是![]() 在氢氧化钠水溶液、加热条件下发生水解反应生成
在氢氧化钠水溶液、加热条件下发生水解反应生成![]() ,反应方程式为:
,反应方程式为:  +NaOH
+NaOH 。
。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】25°C时,向NaHCO3溶液中滴入盐酸,混合溶液的pH与离子浓度变化的关系如图所示。下列叙述正确的是

A.图中a=2.6
B.25℃时,HCO3-+H2O![]() H2CO3+OH-的Kh=1.0×10-6.4
H2CO3+OH-的Kh=1.0×10-6.4
C.M点溶液中:![]()
D.若要表示题目条件下pH与lg![]() 的变化关系.则曲线应该在平行于曲线
的变化关系.则曲线应该在平行于曲线![]() 的下方
的下方
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X为一种常见酸的浓溶液,能使蔗糖粉末变黑。A与X反应的转化关系如图所示,
其中反应条件及部分产物均已略去,则下列有关说法正确的是
A.X使蔗糖变黑的现象主要体现了X的强氧化性
B.若A为铁,则足量A与X在室温下即可完全反应
C.若A为碳单质,则将C通入少量的澄清石灰水中,最后有白色沉淀产生
D.工业上,B转化为D的反应条件为加热、使用催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与我们的生活密切相关,请回答:
(1)在生活中要注意饮食平衡,蛋白质属于_______(填序号,下同)食物,番茄属于______食物;①酸性 ②碱性
(2)有四种常见药物①阿司匹林、②青霉素、③胃舒平、④麻黄碱. 某同学胃酸过多,应该服用______(填序号,下同);从用药安全角度考虑,使用前要进行皮肤敏感性测试的是_____;由于具有兴奋作用,国际奥委会严禁运动员服用的是_________;
(3)苹果汁是人们喜爱的饮品,由于其中含有Fe2+,现榨的苹果汁在空气中会由浅绿色变为棕黄色,若榨汁时加入维生素C,可有效防止这种现象发生.这说明维生素C具有________(填序号);①氧化性 ②还原性 ③碱性 ④酸性
(4)食用植物油进入人体后,在酶的作用下水解为高级脂肪酸和_________(写名称),进而被氧化成二氧化碳和水并提供能量,或作为合成人体所需其他物质的原料;
(5)硫酸亚铁可用于治疗缺铁性贫血,某贫血患者每天须补充1.4g铁元素,则服用的药物中含硫酸亚铁的质量至少为_________g;
(6)氨基酸是组成蛋白质的基本结构单元,其分子中一定含有的官能团是氨基(﹣NH2)和____(写结构简式或名称).人体中共有二十多种氨基酸,其中人体自身________(填“能”或“不能”)合成的氨基酸称为人体必需氨基酸;
(7)淀粉在淀粉酶的作用下最终水解为葡萄糖(C6H12O6),部分葡萄糖在体内被氧化生成二氧化碳和水.写出葡萄糖在体内被氧化的化学方程式:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室可用NaBr、浓H2SO4、乙醇为原料制备少量溴乙烷:
C2H5—OH+HBr![]() C2H5Br+H2O
C2H5Br+H2O
已知反应物的用量为:0.30 mol NaBr(s);0.25 mol C2H5OH(密度为0.80 g·cm-3);36 mL浓H2SO4(质量分数为98%,密度为1.84 g·mL-1);25 mL水。试回答下列问题。
(1)该实验应选择图中的a装置还是b装置?_____________。

(2)反应装置中的烧瓶应选择下列哪种规格最合适(_____)
A.50 mL B.100 mL C.150 mL D.250 mL
(3)冷凝管中的冷凝水的流向应是(_____)
A. A进B出 B. B进A出 C. 从A进或B进均可
(4)可能发生的副反应为:_____________、__________、______________(至少写出3个方程式)。
(5)实验完成后,须将烧瓶内的有机物蒸出,结果得到棕黄色的粗溴乙烷,欲得纯净溴乙烷,应采用的措施是_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验装置、操作正确,且能实现相应实验目的的是:
实验装置 | 实验操作 | 实验目的 | |
A |
| 用标准KMNO4溶液滴定Na2S2O3溶液 | 测定Na2S2O3溶液浓度 |
B |
| 蒸发AlCl3溶液 | 得到AlCl3固体 |
C |
| 逐滴滴加 AgNO3 溶液 | 根据沉淀产生的先后顺序确定Ksp(A gCl)和Ksp(AgI)的大小 |
D |
| 加热 NH4Cl 固体 | 制备 NH3 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】炭黑是雾霾中的重要颗粒物,研究发现它可以活化氧分子,生成活化氧。活化过程的能量变化模拟计算结果如图所示。活化氧可快速氧化 SO2。下列说法错误的是:

A.每活化一个氧分子放出 0.29 eV 能量
B.水可使氧分子活化反应的活化能降低 0.18 eV
C.氧分子的活化是氧氧共价键的断裂与碳氧共价键的生成过程
D.无水条件下该过程的活化能为 1.04 eV
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,向Na2CO3溶液中滴入盐酸,混合溶液的pH与离子浓度变化的关系如图所示。已知:lg X=lg![]() 或lg
或lg![]() ,下列叙述正确的是
,下列叙述正确的是

A.25 ℃时,CO32-+H2O![]() HCO3-+OH-的平衡常数为1.0×10-7.6
HCO3-+OH-的平衡常数为1.0×10-7.6
B.当溶液呈中性时,c(Na+)=c(HCO3-)+2c(CO32-)
C.曲线m表示pH与 -lg![]() 的变化关系
的变化关系
D.Ka1(H2CO3)的数量级为10-7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组的同学用如图所示装置研究电化学问题。当闭合该装置的电键时,观察到电流计的指针发生偏转。下列有关说法正确的是( )

甲 乙
A.该装置为两个原电池串联
B.乙装置中Pt作负极C作正极
C.当甲中产生0.1 mol气体时,乙中析出固体的质量为6.4 g
D.实验一段时间后,甲烧杯中溶液的pH减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com