
| A. | I2→I+I | B. | H+Cl=HCl | C. | H+H=H2 | D. | S+O2=SO2 |
科目:高中化学 来源: 题型:选择题
| A. | 若温度不变,将容器的体积缩小到原来的一半,此时A的浓度为原来的2.1倍,则m+n<p+q | |
| B. | 若平衡时,A、B的转化率相等,说明反应开始时,A、B的物质的量之比为m:n | |
| C. | 若m+n=p+q,则往含有a mol气体的平衡体系中再加入a mol的B,达到新平衡时,气体的总物质的量等于2a | |
| D. | 若温度不变时,压强增大到原来的2倍,达到新平衡时,总体积一定比原来的$\frac{1}{2}$要小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠在氯气中燃烧 | B. | 二氧化碳通入澄清的石灰水中 | ||
| C. | 氯化钠溶液中滴加硝酸银溶液 | D. | 锌粒放入稀硫酸中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1L pH=l的硫酸溶液中含有的H+数目为0.2NA | |
| B. | 1 mol羟基与l mol氢氧根离子所含质子数均为9NA | |
| C. | 14 g由N2与CO组成的混合气体中含有的原子数目为2NA | |
| D. | 标准状况下,2.24 L Cl2溶于水,转移的电子数目为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
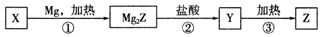
| A. | X可以和氢氟酸反应 | |
| B. | 甲烷的稳定性比Y强 | |
| C. | Z是将太阳能转换为电能的常用材料 | |
| D. | 上述①②③变化过程中,依次发生置换反应、复分解反应和分解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 水是一种很好的溶剂 | B. | 水在人体内还有调节体温的作用 | ||
| C. | 饮用水越纯净对身体越好 | D. | 水是反应介质和反应物 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 弱酸性溶液中:Na+、NH4+、NO3-、Cl- | |
| B. | 无色溶液中:Fe3+、NH4+、Cl-、HS- | |
| C. | 水电离出的C(H+)=1×10-13mol•L-1的溶液中:Ca2+、HCO3-、I-、NO3- | |
| D. | 漂白粉的水溶液中:Fe2+、SO42-、Mg2+、Na+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
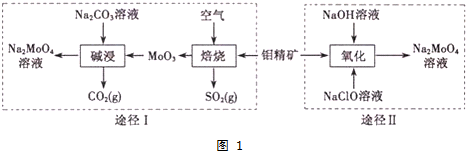

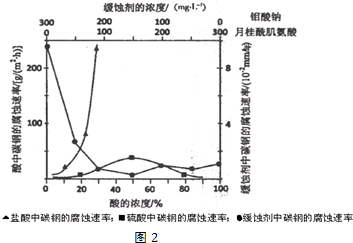
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com