
 某分子的球棍模型如图所示.已知分子中所有原子的最外层均达到 8 电子稳定结构,原子间以单键相连.下列有关说法中一定错误的是( )
某分子的球棍模型如图所示.已知分子中所有原子的最外层均达到 8 电子稳定结构,原子间以单键相连.下列有关说法中一定错误的是( )| A. | X原子可能为第VA族元素 | |
| B. | 该分子中既含有极性共价键又含有非极性共价键 | |
| C. | Y 原子可能为第ⅠA 族或第ⅦA 族元素元素 | |
| D. | 从圆球的大小分析,该分子可能为 N2F4 |
分析 根据球棍模型可知X能形成3个共价键,则X最外层含有5个电子,Y形成1个共价键,且最外层达到8电子稳定结构,则Y原子最外层含有7个电子,据此分析.
解答 解:由球棍模型可知X能形成3个共价键,则X最外层含有5个电子,Y形成1个共价键,且最外层达到8电子稳定结构,则Y原子最外层含有7个电子,
A、由球棍模型可知X能形成3个共价键,则X最外层含有5个电子,则X原子可能为ⅤA族元素,故A正确;
B、该分子中,X-Y键为极性键,X-X键为非极性键,故B正确;
C、Y形成1个共价键,且最外层达到8电子稳定结构,则Y原子最外层含有7个电子,则Y原子只能为VIIA族元素,故C错误;
D、F原子的半径小于N原子,则从圆球的大小分析,该分子可能为N2F4,故D正确.
故选:C.
点评 本题考查了球棍模型的分析判断,判断化合物的化学式进而判断XY原子在周期表中的位置是解答的关键,难度不大.


 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案科目:高中化学 来源: 题型:推断题
 ;
; ;A、B、E形成的化合物
;A、B、E形成的化合物 ;D、E形成的化合物
;D、E形成的化合物 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 粒子代码 | a | I | e |
| 原子核数 | 单核 | 四核 | 二核 |
| 粒子的电荷数 | 一个单位正电荷 | 0 | 一个单位负电荷 |

 .;
.; .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
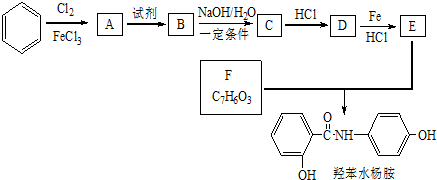
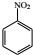 $→_{HCl}^{Fe}$
$→_{HCl}^{Fe}$
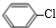 +HNO3$→_{△}^{浓H_{2}SO_{4}}$
+HNO3$→_{△}^{浓H_{2}SO_{4}}$ +H2O.
+H2O.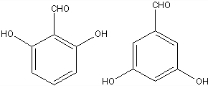 、
、 .
.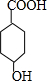 $\stackrel{一定条件下}{→}$
$\stackrel{一定条件下}{→}$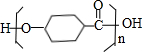 +(n-1)H2O.
+(n-1)H2O.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
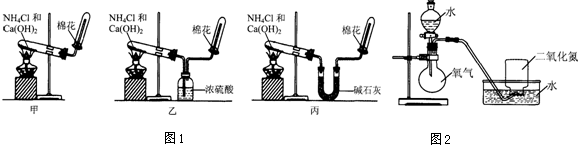
| 实验过程 | 实验现象 | |
| 步骤一 | 将收集满NO2的集气瓶倒立在水槽中. | 集气瓶中液面上升;集气瓶中气体由红棕色变成无色;最终剩余气体约占集气瓶体积的三分之一. |
| 步骤二 | 将分液漏斗中的水逐滴滴入烧瓶,使少量O2进入盛有NO2的集气瓶后,停止滴水. | 集气瓶中气体颜色的变化情况是先由无色变为红棕色,再变成无色;集气瓶中液面继续上升. |
| 步骤三 | 多次重复步骤二操作,并依次减少O2通入量,直至O2通入后,气体不再变成红棕色. | 现象与步骤二相同,最后集气瓶内几乎充满液体,只含极少量气体. |
| 计算 | 用上述实验方法,将标准状况下448mLNO2全部溶于水,得到500mL溶液,则溶液中HNO3的物质的量浓度为0.04mol/L. | |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com