
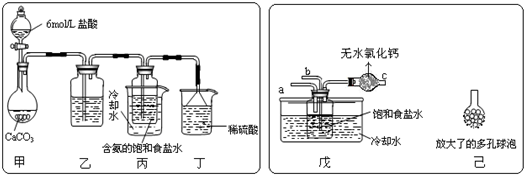
分析 (Ⅰ)依据题干中信息碳酸氢钠溶解度相对较小分析判断;
(Ⅱ)(1)①依据用盐酸制取二氧化碳时常会含有氯化氢气体分析即可解答;
②依据稀硫酸能与氨气反应分析解答;
③依据分离固体与液体采用的实验操作分析解答,过滤操作可需要的主要仪器是漏斗、烧杯、玻璃棒及铁架台等;
(2)①根据氨气易溶于水,从制取碳酸氢钠时先要得到含氨的饱和食盐水分析解答;
②从装置改动后反应物的接触面积变大分析判断.
解答 解:(Ⅰ)A.碳酸氢钠易溶于水,故错误;
B.碳酸氢钠受热易分解,与其在溶液中首先结晶析出无关,故错误;
C.碳酸氢钠的溶解度相对于氯化铵来说碳酸氢钠的溶解度更小一些,所以在溶液中首先结晶析出,故正确;
故答案为:C;
(Ⅱ)(1)①利用盐酸制取二氧化碳时,因盐酸易挥发,所以,二氧化碳中常会含有氯化氢气体,碳酸氢钠能与盐酸反应不与二氧化碳反应,所以通过碳酸氢钠的溶液是可以除掉二氧化碳气体中的氯化氢气体,故答案为:饱和碳酸氢钠溶液;
②实验过程中氨气可能有剩余,而稀硫酸能与氨气反应,所以稀硫酸的作用是吸收末反应的NH3,故答案为:吸收未反应的NH3;
③分离出NaHCO3晶体的操作是分离固体与液体,常采用的实验操作是过滤操作,此操作需要的玻璃仪器有玻璃棒、漏斗及烧杯,故答案为:过滤;玻璃棒;漏斗;烧杯;
(2)①制取碳酸氢钠时先要得到含氨的饱和食盐水,氨气极易溶于水,二氧化碳能溶于水,则应先通入氨气,能形成较大浓度的溶液,有利于二氧化碳吸收,生成更多的碳酸氢铵,故a端通入NH3,故答案为:NH3;氨气极易溶解于水,能形成较大浓度的溶液,有利于二氧化碳吸收,生成更多的碳酸氢铵;
②装置改动后反应物的二氧化碳与溶液的接触面积变大,提高了二氧化碳的吸收率,故答案为:增大气体与溶液接触面积,提高CO2吸收率.
点评 本题主要考查“侯氏制碱法”的反应原理,题目较为综合,难度较大,解答须明晰制碱的原理.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 10℃20mL 3 mol•L-1的NaHCO3溶液 | B. | 20℃30mL 2 mol•L-1的NaHCO3溶液 | ||
| C. | 20℃10mL 4 mol•L-1的NaHCO3溶液 | D. | 10℃10mL 2 mol•L-1的NaHCO3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,4.4g CO2物质的量为0.1mol | |
| B. | 常温常压下,6.2g Na2O含有的Na+离子数为0.1mol | |
| C. | 标准状况下,1NA个H2O分子含有氧分子数为1mol | |
| D. | 标准状况下,22.4L酒精的物质的量为1mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 无色气体的质量为0.2g | |
| B. | 原混合物中铁的质量分数无法计算 | |
| C. | 实验中消耗的H2SO4物质的量为0.1mol | |
| D. | 溶液中金属离子物质的量为0.02mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 实验室需要0.1mol/L NaOH溶液450mL和0.5mol/L硫酸溶液450mL.根据这两种溶液的配制情况回答下列问题:
实验室需要0.1mol/L NaOH溶液450mL和0.5mol/L硫酸溶液450mL.根据这两种溶液的配制情况回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 制纯碱:往NaOH溶液中 通入少量CO2气体,再蒸发溶液 | |
| B. | 制氯气:以粗盐为原料,经过除杂、浓缩得饱和食盐水,再进行电解所得溶液 | |
| C. | 制镁:用海水为原料,经一系列过程制得氧化镁固体,再用H2还原得镁 | |
| D. | 制铝:从铝土矿中获得氧化铝再得到氯化铝固体,电解熔融的氯化铝得到铝 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
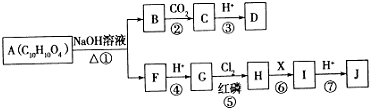
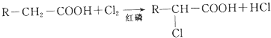
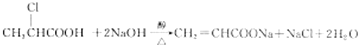 .
.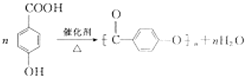 .
. .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com