

分析 (1)水蒸气喷到灼热的炭层上发生反应生成CO和H2;
(2)根据(1)煤和水蒸气的反应生成一氧化碳和氢气要吸热,故喷入空气的目的是让部分炭燃烧,提供炭与水蒸气反应所需要的热量;一氧化碳和氢气,在一定条件下合成甲醇,据此书写方程式;
(3)依据自发进行的判断依据△H-T△S<0分析;
(4)CO一空气燃料电池,氧气在正极得电子发生还原反应;
(5)①依据转化率曲线分析判断;
②图象分析速率随温度变化的趋势分析回答.
解答 解:(1)水蒸气喷到灼热的炭层上发生反应生成CO和H2,则该反应的化学方程式是C+H2O=CO+H2,故答案为:C+H2O=CO+H2;
(2)根据(1)煤和水蒸气的反应生成一氧化碳和氢气要吸热,故喷入空气的目的是让部分炭燃烧,提供炭与水蒸气反应所需要的热量;
一氧化碳和氢气在一定条件下合成甲醇的原理为:CO+2H2$\frac{\underline{\;一定温度\;}}{催化剂}$CH3OH;
故答案为:让部分炭燃烧,提供炭与水蒸气反应所需要的热量;CO+2H2$\frac{\underline{\;一定温度\;}}{催化剂}$CH3OH;
(3)CO(g)+3H2(g)?CH4(g)+H2O(g),反应△S<0,依据自发进行的判断依据△H-T△S<0,所以△H<0,故答案为:该反应△H<0;
(4)CO一空气燃料电池,氧气在正极得电子发生还原反应,电解质是搀杂了Y2O3的ZrO2晶体,它在高温下能传导O2-,该电池正极的电极反应式为:O2+4e-=2O2-,故答案为:O2+4e-=2O2-;
(5)①从反应压强对甲醇转化率的影响“效率“看,图象中转化率较大的是4.0×106Pa,故选:b;
②依据图象分析温度在高于80°C对反应速率影响不大,反应是放热反应,温度过高,平衡逆向进行,不利于转化率增大,所以实际工业生产中采用的温度是80℃,故答案为:80℃;温度低于80℃,反应速率较小;温度高于80℃,升温对反应速率影响较小,且该反应放热,升高温度平衡逆向移动,转化率降低.
点评 本题主要考查了电极方程式及其化学方程式的书写、图象分析判断,题目难度中等,重在培养学生能够利用化学知识提取题干的信息进行答题的能力,综合性强,难度较大.


科目:高中化学 来源: 题型:选择题
| A. | 过滤操作中,漏斗下端要紧靠烧杯内壁,而分液操作中,无此要求 | |
| B. | 蒸馏操作时,应使温度计水银球插入蒸馏烧瓶的溶液中 | |
| C. | 蒸发操作时,应用玻璃棒不断搅拌待有大量晶体出现,停止搅拌,继续把水份蒸干 | |
| D. | 分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
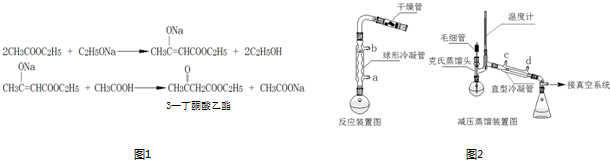
 CH3COOCH2CH3+H2O,反应类型是酯化反应.
CH3COOCH2CH3+H2O,反应类型是酯化反应.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
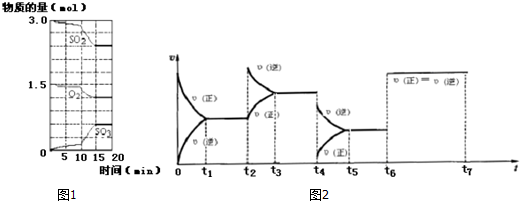
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学键 | H-H | O=O | H-O |
| 键能kJ/mol | 436 | 496 | 463 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 银盐 性质 | AgCl | AgBr | AgCN | Ag2CrO4 | AgSCN |
| 颜色 | 白 | 浅黄 | 白 | 砖红 | 白 |
| 溶解度(mol•L-1) | 1.34×10-6 | 7.1×10-7 | 1.1×10-8 | 6.5×10-5 | 1.0×10-6 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 平衡常数K增大 | B. | a+b<c+d | C. | X的转化率下降 | D. | Z的体积分数增加 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
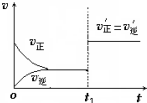 在其他条件不变的情况下,降低温度平衡向正反应方向移动,为放热反应(选填“吸热”、“放热”).如图为反应速率(ν)与时间(t)关系的示意图,由图判断,在t1时刻曲线发生变化的原因是c(填写编号).
在其他条件不变的情况下,降低温度平衡向正反应方向移动,为放热反应(选填“吸热”、“放热”).如图为反应速率(ν)与时间(t)关系的示意图,由图判断,在t1时刻曲线发生变化的原因是c(填写编号).查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com