
| A�� | ���ܽ�����������������Ȱ����������仯���ְ����Ż�ѧ�仯 | |
| B�� | �Ȼ�������ˮ�ﵽ���ͺ��ܽ���̲�û��ֹͣ | |
| C�� | �Ȼ�������ˮ�У������Ƿ��γɱ�����Һ���������ܽ���ᾧ�Ĺ��� | |
| D�� | ��K37ClͶ�뵽K35Cl�ı�����Һ�У���Һ�����ʵ��������С |
���� A��һ��˵���κ����ʵ��ܽ���̶����������仯�ͻ�ѧ�仯������ɢ����Ϊ�����仯��ˮ�Ϲ���Ϊ��ѧ�仯��
B��������Һ�н����˳����ܽ�ƽ�⣬�ܽ����������������ȣ���û��ֹͣ��
C����Һֻ�дﵽ������Һʱ���о���������
D�����ݳ����ܽ�ƽ��ԭ��������
��� �⣺A��һ��˵���κ����ʵ��ܽ���̶����������仯�ͻ�ѧ�仯������ɢ����Ϊ�����仯��ˮ�Ϲ���Ϊ��ѧ�仯����A��ȷ��
B��������Һ�н����˳����ܽ�ƽ�⣬�ܽ����������������ȣ���û��ֹͣ����B��ȷ��
C����Һֻ�дﵽ������Һʱ���о������������Ȼ�������ˮ��δ�ﵽ������Һʱ�����ڽᾧ�Ĺ��̣���C����
D����K37ClͶ�뵽K35Cl�ı�����Һ�У����ڴ��ڳ����ܽ�ƽ�⣬�ܽ���̺ͳ�������ͬʱ���ڣ�K37Cl�ܽ��ͬʱ����K35Cl����������Һ��K35Cl���������С����D��ȷ��
��ѡC��
���� ���⿼���˳����ܽ�ƽ���ԭ�����ܽ�������������ʵ���Դ�С���Լ�����ֻ�дﵽ������Һʱ�����о��������������Ѷ��еȣ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
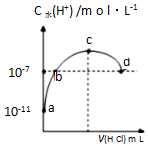 �����£���20mL 0.1mol•L-1��ˮ��Һ�еμ�һ��Ũ�ȵ�ϡ���ᣬ��Һ����ˮ�����������Ũ���������������ı仯��ͼ��ʾ��������˵����ȷ���ǣ�������
�����£���20mL 0.1mol•L-1��ˮ��Һ�еμ�һ��Ũ�ȵ�ϡ���ᣬ��Һ����ˮ�����������Ũ���������������ı仯��ͼ��ʾ��������˵����ȷ���ǣ�������| A�� | �����£�0.1mol•L-1��ˮ�ĵ��볣��KԼΪ1��10-5mol•L-1 | |
| B�� | a��b֮��ĵ�һ�����㣺c��NH4+����c��Cl-����c��OH-����c��H+�� | |
| C�� | c����Һ��c��NH4+��=c��Cl-�� | |
| D�� | d���������Һǡ����ȫ��Ӧ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��H1��0��H3��0 | B�� | ��H5��0��H4����H3 | C�� | ��H1=��H2+��H3 | D�� | ��H3=��H4+��H5 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 2FeCO3��s��+$\frac{1}{2}$O2 ��g��=Fe2O3��s��+2CO2��g����H=+130 KJ/mol | |
| B�� | 4 FeCO3��s��+O2 ��g��=2Fe2O3��s��+4CO2��g����H=+260 KJ/mol | |
| C�� | 4 FeCO3��s��+O2 ��g��=2Fe2O3��s��+4CO2��g����H=-260 KJ/mol | |
| D�� | 4 FeCO3��s��+O2 ��g��=2Fe2O3��s��+4CO2��g����H=-260 KJ/mol |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��Ӧ��ʣ�����Ϊ̼���� | B�� | �ų�����ΪCO2��ˮ���� | ||
| C�� | NaOH������Ϊ13.6g | D�� | NaHCO3������Ϊ18g |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��������ӵĵ���ʽ 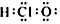 | B�� | CH4Si�Ľṹʽ 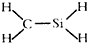 | ||
| C�� | HCN���ӵĽṹʽ��H-C��N | D�� | ������ӵı���ģ�� 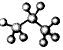 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 �밴Ҫ��ش������йص��Ļ����������ط�Ӧ�����⣺
�밴Ҫ��ش������йص��Ļ����������ط�Ӧ�����⣺| n��NO��/mol | n��CO��/mol | n��N2��/mol | n��CO2��/mol | |
| ��ʼ | 1.2 | 1.0 | 0 | 0 |
| 2minĩ | 0.4 | |||
| 4minĩ | 0.8 |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com