
已知几种盐的熔点及其熔化时能量改变值如下所示:
盐 | 熔点/℃ | 质量(g)数值与相对分子质量相等的盐熔化时吸热/kJ |
CaCl2·6H2O | 29.0 | 37.3 |
Na2SO4·10H2O | 32.4 | 77.0 |
Na2HPO4·12H2O | 36.1 | 100.1 |
Na2S2O3·5H2O | 48.5 | 49.7 |
下列有关说法正确的是( )
A.不应选用CaCl2·6H2O
B.可选用Na2SO4·10H2O和Na2HPO4·12H2O
C.最好选用Na2SO4·10H2O,它更加经济
D.以上皆不宜选用
解析:(1)从提供的四种盐的熔点及熔化时吸收热量的情况来分析,应考虑其熔点以接近常温为宜,熔化及凝固时能量变化越大越好(更有利于调节室温)。四种盐的熔点均不是很高,熔化时均能吸收较多热量,这样从化学原理上讲,四种盐理论上均可选用,则选项A、D可排除。
(2)从实际出发(屋顶承重越轻越好),应考虑单位质量的固体盐在熔化时吸热越多越好。再以单位质量盐熔化时吸收热量的情况(Na2SO4·10H2O为77.0 kJ÷322 g≈0.24 kJ·g-1,Na2HPO4·12H2O为100.1 kJ÷358 g≈0.28 kJ·g-1)来看,两者热量变化值均较大,且比较接近,Na2HPO4·12H2O的热量变化值略大一些。
(3)从家庭或单位使用的角度,应是产品丰富、价格便宜的为首选材料。从两种盐的来源来看,Na2SO4·10H2O的俗名为芒硝,是天然存在的一种物质,开采方便,价格便宜;Na2HPO4·12H2O需人工制取,其价格相对昂贵一些。
答案:BC


 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案 小学教材完全解读系列答案
小学教材完全解读系列答案科目:高中化学 来源: 题型:
 某化学反应中,设反应物的总能量为E1,生成物的总能量为E2.
某化学反应中,设反应物的总能量为E1,生成物的总能量为E2.
| 盐 | 熔点/℃ | 熔化吸热/KJ?mol-1 | 参考价格/元?kg-1 |
| CaCL2?6H2O | 29,0 | 37,3 | 780~850 |
| Na2SO4?10H2O | 32,4 | 77,0 | 800~900 |
| Na2HPO4?12H2O | 36,1 | 100,1 | 1600~2000 |
| Na2S2O3?5H2O | 48,5 | 49,7 | 1400~1800 |
查看答案和解析>>
科目:高中化学 来源: 题型:
盐 | 熔点/℃ | 熔化吸热/kJ·mol-1 | 参考价格/元·kg-1 |
CaCl2·6H2O | 29.0 | 37.3 | 780~850 |
Na2SO4·10H2O | 32.4 | 77.0 | 800~900 |
Na2HPO4·12H2O | 36.1 | 100.1 | 1 600~2 000 |
Na2SiO3·5H2O | 48.5 | 49.7 | 1 400~1 800 |
其中最适宜作为储能介质的是( )
A.CaCl2·6H2O B.Na2SO4·10H2O
C.Na2HPO4·12H2O D.Na2SiO3·5H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
(6分)按要求回答下列问题:
(1)已知在200℃,101kPa时,H2与碘蒸气作用生成1mol HI放出7.45kJ热量,则该反应的热化学方程式为 。
(2)太阳能的开发和利用是21世纪一个重要课题。利用储能介质储存太阳能的原理是:白天在太阳照射下使某种盐熔化,吸收热量,晚间熔盐固化释放出相应能量。已知下列数据:
| 序号 | 盐 | 熔点/℃ | 熔化热/ | 参考价格/ |
| ① | CaCl2·6H2O | 29.0 | 37.3 | 780~850 |
| ② | Na2SO4·10H2O | 32.4 | 77.0 | 800~900 |
| ③ | Na2HPO4·12H2O | 36.1 | 100.1 | 1800~2400 |
| ④ | Na2SiO3·5H2O | 52.5 | 49.7 | 1400~1800 |
其中最适宜作为储能介质的是 。(选填物质序号)
(3)离子晶体晶格能的定义是气态离子形成1mol离子晶体释放的能量,通常取正值。现已知:
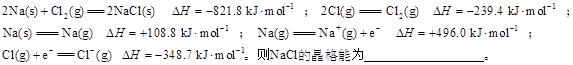
查看答案和解析>>
科目:高中化学 来源:2011-2012年湖北省黄冈中学高二上学期期中考试化学试卷 题型:填空题
(6分)按要求回答下列问题:
(1)已知在200℃,101kPa时,H2与碘蒸气作用生成1mol HI放出7.45kJ热量,则该反应的热化学方程式为 。
(2)太阳能的开发和利用是21世纪一个重要课题。利用储能介质储存太阳能的原理是:白天在太阳照射下使某种盐熔化,吸收热量,晚间熔盐固化释放出相应能量。已知下列数据:
| 序号 | 盐 | 熔点/℃ | 熔化热/ | 参考价格/ |
| ① | CaCl2·6H2O | 29.0 | 37.3 | 780~850 |
| ② | Na2SO4·10H2O | 32.4 | 77.0 | 800~900 |
| ③ | Na2HPO4·12H2O | 36.1 | 100.1 | 1800~2400 |
| ④ | Na2SiO3·5H2O | 52.5 | 49.7 | 1400~1800 |

查看答案和解析>>
科目:高中化学 来源:2011-2012年湖北省高二上学期期中考试化学试卷 题型:填空题
(6分)按要求回答下列问题:
(1)已知在200℃,101kPa时,H2与碘蒸气作用生成1mol HI放出7.45kJ热量,则该反应的热化学方程式为 。
(2)太阳能的开发和利用是21世纪一个重要课题。利用储能介质储存太阳能的原理是:白天在太阳照射下使某种盐熔化,吸收热量,晚间熔盐固化释放出相应能量。已知下列数据:
|
序号 |
盐 |
熔点/℃ |
熔化热/ |
参考价格/ |
|
① |
CaCl2·6H2O |
29.0 |
37.3 |
780~850 |
|
② |
Na2SO4·10H2O |
32.4 |
77.0 |
800~900 |
|
③ |
Na2HPO4·12H2O |
36.1 |
100.1 |
1800~2400 |
|
④ |
Na2SiO3·5H2O |
52.5 |
49.7 |
1400~1800 |
其中最适宜作为储能介质的是 。(选填物质序号)
(3)离子晶体晶格能的定义是气态离子形成1mol离子晶体释放的能量,通常取正值。现已知:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com