
下列说法正确的是( )
A.因为焓变和熵变都与反应的自发性有关,因此焓变或熵变均可以单独作为反应自发性的判据
B.对于能够自发进行的吸热反应,其原因是体系有自发地向混乱度增加的方向转变的倾向
C.ΔH<0、ΔS>0的反应在温度低时不能自发进行
D.在其他外界条件不变的情况下,使用催化剂,可以改变化学反应进行的方向
 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案科目:高中化学 来源:2015-2016学年云南省高二下学期期中化学试卷(解析版) 题型:填空题
下图是一个简易测量物质反应是吸热还是放热的实验装置,利用此装置可以很方便地测得某反应是放热反应还是吸热反应。请根据装置回答下列问题:

(1)将铝片加入小试管内,然后注入足量的盐酸,有关反应的离子方程式是_____________________,试管中看到的现象是_______________________。
(2)弯管中A端液面________(填“上升”或“下降”),原因是_________________;说明此反应是________(填“放热”或“吸热”)反应。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年新疆农业大学附中高一下学期期中化学试卷(解析版) 题型:选择题
甲醇燃料电池(DMFC)可用于笔记本电脑、汽车等,它一极通入甲醇;电解质是质子交换膜,它能传导氢离子。电池工作时,甲醇被氧化为二氧化碳和水。下列叙述中,不正确的是
A.负极的反应式为: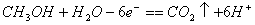
B. 氧气在电极上的反应是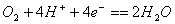
C. 通入甲醇的一极为负极,通入氧气的一极为正极
D. 燃料电池的能量转化率能达到100%
查看答案和解析>>
科目:高中化学 来源:2015-2016学年新疆农业大学附中高二下学期期中化学试卷(解析版) 题型:填空题
请仔细观察下列五种装置的构造示意图,完成下列问题。
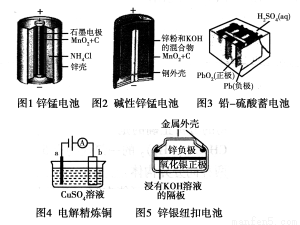
(1)锌锰电池存在自放电现象,主要原因是锌与NH4Cl反应,请结合离子方程式与文字说明原因:
。
(2)碱性锌锰电池的总反应式:Zn+2MnO2+2H2O===2MnOOH+Zn(OH)2,则负极的电极反应式:________________。
(3)铅-硫酸蓄电池放电的总反应式:Pb+PbO2+2H2SO4=2PbSO4+2H2O,充电过程中,阳极附近c(SO42-)浓度将________(填“变大”、“变小”或“不变”),充电时阴极的电极反应式为:________________。
(4)电解精炼铜时,a极是________(填“纯铜”或“粗铜”)。锌银纽扣电池在工作过程中________(填物质名称)被还原。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年新疆农业大学附中高二下学期期中化学试卷(解析版) 题型:选择题
用标准盐酸滴定未知浓度的NaOH溶液,下列操作不会引起实验误差的是( )
A.用蒸馏水洗净酸式滴定管后,装入标准盐酸进行滴定
B.用蒸馏水洗净锥形瓶后,再用NaOH溶液润洗,后装入NaOH溶液进行滴定
C.用碱式滴定管取10.00 mL NaOH溶液放入蒸馏水洗净的锥形瓶中,加入少量的蒸馏水再进行滴定
D.用酚酞作指示剂滴至红色刚变无色时即停止加盐酸
查看答案和解析>>
科目:高中化学 来源:2015-2016学年新疆农业大学附中高二下学期期中化学试卷(解析版) 题型:选择题
某化学反应的能量变化如下图所示。下列有关叙述正确的是( )

A.该反应的反应热ΔH=E2-E1
B.该反应为放热反应
C.催化剂能改变反应的活化能
D.催化剂能改变反应的焓变
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河北省高二下期末化学试卷(解析版) 题型:选择题
如图所示装置Ⅰ是一种可充电电池,装置II为电解池.离子交换膜只允许Na+通过,充放电的化学方程式为2Na2S2+NaBr3  Na2S4+3NaBr。闭合开关K时,b极附近先变红色.下列说法正确的是( )
Na2S4+3NaBr。闭合开关K时,b极附近先变红色.下列说法正确的是( )
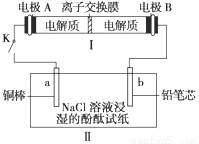
A.负极反应为4Na-4e-=4Na+
C.闭合K后,b电极附近的pH变小
B.当有0.01 mol Na+通过离子交换膜时,b电极上析出气体112 mL
D.闭合K后,a电极上产生的气体具有漂白性
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖南省高一下期末化学试卷(解析版) 题型:填空题
在一定温度下,发生如下反应:N2(g)+3H2(g)  2NH3(g),起始时,充入的N2和H2的物质的量分别是3.0 mol和6.0 mol,2min后反应达到平衡,平衡时NH3的物质的量与H2的物质的量相等,已知容器的容积为5.0 L且不可变,试回答下列问题:
2NH3(g),起始时,充入的N2和H2的物质的量分别是3.0 mol和6.0 mol,2min后反应达到平衡,平衡时NH3的物质的量与H2的物质的量相等,已知容器的容积为5.0 L且不可变,试回答下列问题:
(1) 其达到平衡状态的标志是____________________。
①氨的生成速率与氨的分解速率相等
②断开1个N≡N键的同时有6个N—H键生成
③N2、H2、NH3的体积分数不再变化
④气体的总压强不变
⑤N2、H2、NH3分子数之比为1:3:2
⑥N2、H2和NH3的浓度相等
⑦v(N2)=1/3v(H2)
⑧v正(N2)=1/3v逆(H2)
⑨混合物的密度不变
⑩混合物的平均相对分子质量不变
A.①③④⑤⑦⑩ B.①③④⑧⑩
C.①③④⑤⑧⑩ D.全部
(2)从反应开始到达到平衡用N2表示该反应的速率为: mol·L-1·min-1。
(3)平衡时H2的物质的量浓度为 mol·L-1。
(4)H2的转化率是____________。
(5)平衡时混合气体中NH3的体积分数是_______%(保留一位小数)。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年宁夏高二下期末化学试卷(解析版) 题型:选择题
以极性键结合的多原子分子,分子是否有极性取决于分子的空间构型。下列分子都属于含极性键的非极性分子的是
A.CO2 H2O B.NH3 BCl3 C.P4 CH4 D.CS2 BF3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com