
| A. | 达到平衡后,若将容器体积压缩为2 L,则正反应速率将增大,逆反应速率将减小 | |
| B. | 反应前5秒钟内,用CO表示的平均反应速率为0.04 mol•L-1•s-1 | |
| C. | 当v正(CO)=2v逆(N2)时,该反应中NO的物质的量不再改变 | |
| D. | 保持压强不变,往容器中充入1 mol He,正、逆反应速率都不改变 |
分析 A、压强增大正逆反应速率都增大;
B、根据v=$\frac{△c}{△t}$计算前10s内v(N2),再利用速率之比等于化学计量数之比计算前10s内v(CO);
C、可逆反应达平衡时,用不同物质表示正、逆速率之比等于化学计量数之比;
D、保持压强不变,往容器中充入1 mol He,各组分浓度减小.
解答 解:A、达到平衡后,若将容器体积压缩为2 L,压强增大,各组分浓度增大,正逆反应速率都增大,故A错误;
B、v(N2)=$\frac{△c}{△t}$=$\frac{\frac{1mol}{5L}}{10s}$=0.02mol/(L•s),所以v(CO)=2×0.02mol/(L•s)=0.04mol/(L•s),所以反应前5秒钟内,用CO表示的平均反应速率大于0.04 mol•L-1•s-1,故B错误;
C、v正(CO)=2v逆(N2),说明正逆反应速率相等,反应达到平衡状态,各组分浓度不再变化.故C正确;
D、保持压强不变,往容器中充入1 mol He,各组分浓度减小,正逆反应速率都减小,故D错误;
故选C.
点评 本题考查化学反应速率计算与影响因素、化学平衡状态判定、影响化学平衡的因素等,难度中等,注意D中,开始反应物的浓度减小,反应速率减慢.


 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案科目:高中化学 来源: 题型:选择题
| A. | 原子半径按X、Y、Z的顺序增大 | |
| B. | 单质的氧化性按X、Y、Z的顺序减弱 | |
| C. | 元素的非金属性按X、Y、Z的顺序增强 | |
| D. | 气态氢化物稳定性按X、Y、Z的顺序减弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子半径:Na+>Mg2+>Al3+>F- | B. | 热稳定性:HCl>H2S>PH3>AsH3 | ||
| C. | 酸性强弱:H2SiO3<H2CO3<H3PO4 | D. | 熔点:SiO2>NaCl>I2>CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
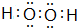
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 主族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 1 | J | |||||||
| 2 | E | K | F | |||||
| 3 | A | C | D | I | G | R | ||
| 4 | B | H |
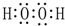 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 吸热反应的发生都需要加热,放热反应在常温下一定容易发生 | |
| B. | 若某反应正向进行时为放热反应,则该反应逆向进行时必为吸热反应 | |
| C. | 由“C(石墨)=C(金刚石)是吸热反应”可知石墨比金刚石稳定 | |
| D. | 不管是吸热反应还是放热反应,升高温度,反应速率均增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 锌片溶解了1 mol,铜片上析出1 mol氢气 | |
| B. | 两极溶解和析出的物质的质量相等 | |
| C. | 锌片溶解了1 g,铜片上析出1 g氢气 | |
| D. | 锌片溶解了1 mol,硫酸消耗了2mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ |
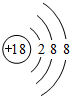 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | B A D C E | B. | E C D A B | C. | A B E D C | D. | C D E B A |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com