
已知:C (s)+ 1/2 O2(g)=CO(g) DH= -110.50KJ/mol
C (s)+O2(g)=CO2(g) DH= -393.51KJ/mol
则反应C (s)+ CO2(g)=2 CO(g)的DH为
A、-283.01KJ/mol B、+172.51 KJ/mol C、+283.01KJ/mol D、-504.01 KJ/mol
 字词句段篇系列答案
字词句段篇系列答案科目:高中化学 来源: 题型:
| ||
| 800℃.Al |
|
|
|
| 1 |
| 2 |
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 步骤Ⅰ |
| Mg,800℃,Ar |
| 步骤II |
| ||
| Ar |
| ||
| Ar |
查看答案和解析>>
科目:高中化学 来源: 题型:
②CO(g)+![]() O2(g)
O2(g) ![]() CO2(g) ΔH2=-282.57 kJ·mol-1
CO2(g) ΔH2=-282.57 kJ·mol-1
③C(s)+O2(g)![]() CO2(g) ΔH3,则ΔH3等于( )
CO2(g) ΔH3,则ΔH3等于( )
A.+172.22 kJ·mol-1 B.-172.22 kJ·mol-1
C.+392.92 kJ·mol-1 D.-392.92 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源:2012届福建省四地六校高三第三次月考化学试卷 题型:填空题
(12分)自洁面料就是在普通的面料纤维中加入一层薄薄的纳米二氧化钛。含有Fe2O3的钛铁矿(主要成分为FeTiO3,Ti的最高价为 +4)制取纳米级TiO2的流程如下:
+4)制取纳米级TiO2的流程如下:
(1)步骤①发生的主要反应是_____ _____ _______(用离子方程式表示)
(2)上述制备二氧化钛的过程中,可以利用的副产物是______________;考虑成本和废物综合利用因素,废液中应加入___________________处理。
(3)由金红石制备单质钛,涉及到的步骤为:
TiO2 TiCl4
TiCl4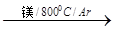 Ti
Ti
已知:①C(s)+O2(g)=CO2(g) △H= -393.5kJ·mol-1
②2CO(g)+O2(g)=2CO2(g) △H= -566.0kJ·mol-1
③TiO2(s)+2Cl2(g)=TiCl4(s)+O2(g) △H= +141.0kJ·mol-1
则TiO2(s)+ 2Cl2(g)+2C(s)=TiCl4(s)+2CO(g)的△H=____________ kJ·mol-1
反应TiCl4+2Mg = 2MgCl2+Ti 在氩气氛中进行的理由是________________________。
(4)TiO2是白色粉末,不溶于水,也不溶于酸,但能溶于氢氟酸和热的浓硫酸中。请写出TiO2与硫酸反应的方程式
查看答案和解析>>
科目:高中化学 来源:2012届山西省高二第二次月考化学试卷 题型:选择题
已知:C(s)+CO2(g) 2CO(g);DH>0。该反应达到平衡后,下列条件有利于反应向正方向进行的是
2CO(g);DH>0。该反应达到平衡后,下列条件有利于反应向正方向进行的是
A.升高温度和减小压强 B.降低温度和减小压强
C.降低温度和增大压强 D.升高温度和增大压强
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com