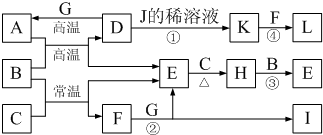
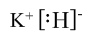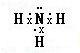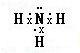解:A、C、E、G为单质,其中A、C、G为金属,L为红褐色固体,L为Fe(OH)
3,B为常见无色液体,B为H
2O,由元素守恒及转化可知,D为Fe
3O
4,G为Al,A为Fe,E为H
2,I的焰色反应呈紫色,I中含K元素,由元素守恒及转化可知,C为K,F为KOH,I为KAlO
2,K与氢气化合生成KH,所以H为KH,常温下A、G投入J的浓溶液无明显现象,K是反应①所得溶液中的唯一溶质,J为硝酸,K为硝酸铁,
(1)由上述分析可知,A为Fe,位于元素周期表中第四周期Ⅷ族,H为KH,其电子式为
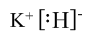
,故答案为:第四周期Ⅷ族;
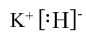
;
(2)反应①的离子方程式为3Fe
3O
4+28H
++NO
3-=9Fe
3++NO↑+14H
2O,反应②的离子方程式为2Al+2OH
-+2H
2O=2AlO
2-+3H
2↑,
故答案为:3Fe
3O
4+28H
++NO
3-=9Fe
3++NO↑+14H
2O;2Al+2OH
-+2H
2O=2AlO
2-+3H
2↑;
(3)反应③为KH+H
2O=KOH+H
2↑,H元素的化合价由-1升高为0,则每生成1molE(KOH),转移电子的物质的量为1mol×(1-0)=1mol,故答案为:1mol.
分析:A、C、E、G为单质,其中A、C、G为金属,L为红褐色固体,L为Fe(OH)
3,B为常见无色液体,B为H
2O,由元素守恒及转化可知,D为Fe
3O
4,G为Al,A为Fe,E为H
2,I的焰色反应呈紫色,I中含K元素,由元素守恒及转化可知,C为K,F为KOH,I为KAlO
2,K与氢气化合生成KH,所以H为KH,常温下A、G投入J的浓溶液无明显现象,K是反应①所得溶液中的唯一溶质,J为硝酸,K为硝酸铁,然后结合单质及化合物的性质来解答.
点评:本题考查无机物的推断,物质的推断是解答本题的关键,明确结合物质的性质及转化关系即可解答,注意L为Fe(OH)
3,B为常见无色液体为解答的突破口,题目难度不大.


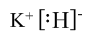 ,故答案为:第四周期Ⅷ族;
,故答案为:第四周期Ⅷ族;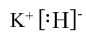 ;
; 

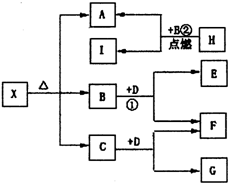 (2011?双流县模拟)如图为一些常见无机物之间的转化关系,已知X是-种盐,H是金属单质,F、I是常见非金属单质,E、G都是工业上重要的碱性物质,它们有如图所示的关系.试回答下列问题:
(2011?双流县模拟)如图为一些常见无机物之间的转化关系,已知X是-种盐,H是金属单质,F、I是常见非金属单质,E、G都是工业上重要的碱性物质,它们有如图所示的关系.试回答下列问题: