

 (或
(或
 ).
).分析 从图中的化合价和原子半径的大小,可知x是H元素,y是C元素,z是N元素,d是O元素,e是Na元素,f是Al元素,g是S元素,h是Cl元素.
(1)Z是N元素,在元素周期表的位置是第二周期VA族;
(2)电子层结构相同的离子,核电荷数越大离子半径越小;非金属性越强,对应氢化物越稳定;
(3)四原子共价化合物,可以是NH3、H2O2、C2H2等;
(4)1molNa的单质在足量O2中燃烧生成Na2O2(s),放出255.5kJ热量,2molNa反应放出热量为511kJ,注明聚集状态、反应热书写热化学方程式;
(5)电解含2mol NaCl和2molNa2SO4的混合水溶液,阳极产生44.8L气体,标准状况下物质的量为2mol,
阳极首先发生反应:2Cl--2e-=Cl2↑,然后发生反应:4OH--4e-=2H2O+O2↑;
(6)①R是NH4Al(SO4)2,溶液中Al3+、NH4+均水解使溶液呈酸性,但Al3+比 NH4+水解程度更大;
②m点过程中加入氢氧化钠,沉淀物质的量不变,是NH4+与OH-反应生成NH3•H2O;
③根据n=cV计算n(Al3+ )、n(NH4+)、n(SO42-)、n(Ba2+)、n(OH-),根据SO42-、Ba2+中不足量的离子的物质的量计算生成BaSO4的物质的量,依次发生:Al3++OH-=Al(OH)3↓、NH4++OH-=NH3•H2O、Al(OH)3+OH-=AlO2-+2H2O,根据方程式计算生成Al(OH)3的物质的量,进而二者计算生成固体总物质的量.
解答 解:从图中的化合价和原子半径的大小,可知x是H元素,y是C元素,z是N元素,d是O元素,e是Na元素,f是Al元素,g是S元素,h是Cl元素.
(1)Z为N元素,在元素周期表的位置是第二周期VA族,故答案为:第二周期VA族;
(2)电子层结构相同的离子,核电荷数越大离子半径越小,故离子半径:r(O2-)>r(Al3+),非金属性越强,对应氢化物越稳定,故稳定性:H2O>H2S,
故答案为:O2-;Al3+;H2O;H2S;
(3)四原子共价化合物,可以是NH3、H2O2、C2H2等,其电子式为: (或
(或
 ),
),
故答案为: (或
(或
 );
);
(4)1molNa的单质在足量O2中燃烧生成Na2O2(s),放出255.5kJ热量,2molNa反应放出热量为511kJ,则该反应的热化学方程式为:2Na(s)+O2(g)=Na2O2(s)△H=-511kJ•mol-1,
故答案为:2Na(s)+O2(g)=Na2O2(s)△H=-511kJ•mol-1;
(5)电解含2mol NaCl和2molNa2SO4的混合水溶液,阳极产生44.8L气体,标准状况下物质的量为2mol,
阳极首先发生反应:2Cl--2e-=Cl2↑,反应产生1mol氯气,转移2mol电子,然后发生反应:4OH--4e-=2H2O+O2↑,n(O2)=2mol-1mol=1mol,反应转移电子的物质的量是4mol,所以电路中转移电子的物质的量为6mol,
故答案为:6;
(6)①盐NH4Al(SO4)2在溶液中发生电离:NH4Al(SO4)2=NH4++Al3++2SO42-,NH4+、Al3+发生水解反应,消耗水电离产生的OH-,使溶液中c(H+)增大,当最终溶液达到平衡时,c(H+)>c(OH-),溶液显酸性;由于Al3+水解程度大于NH4+,因此c(NH4+)>c(Al3+),盐水解程度是微弱的,主要以盐电离产生的离子存在,因此溶液中离子浓度大小关系是:c(SO42-)>c(NH4+)>c(Al3+)>c(H+)>c(OH-),
故答案为:c(SO42-)>c(NH4+)>c(Al3+)>c(H+)>c(OH-);
②m点过程中加入氢氧化钠,沉淀物质的量不变,是NH4+与OH-反应生成NH3•H2O,离子方程式为NH4++OH-=NH3•H2O,
故答案为:NH4++OH-=NH3•H2O;
③10mL 1mol•L-1 NH4Al(SO4)2溶液中Al3+ 物质的量为0.01mol,NH4+的物质的量为0.01mol,SO42-的物质的量为0.02mol,20mL 1.2 mol•L-1Ba(OH)2溶液中Ba2+物质的量为0.024mol,OH-为0.048mol,
由SO42-+Ba2+=BaSO4↓,可知SO42-不足,故可以得到0.02mol BaSO4,
Al3++3OH-=Al(OH)3↓
0.01mol 0.03mol 0.01mol
反应剩余OH-为0.048mol-0.03mol=0.018mol,
NH4++OH-=NH3•H2O
0.01mol 0.01mol
反应剩余OH-为0.018mol-0.01mol=0.008mol,
Al(OH)3+OH-=AlO2-+2H2O
0.008mol 0.008mol
故得到Al(OH)3沉淀为0.01mol-0.008mol=0.002mol
则最终得到固体为0.02mol+0.002mol=0.022mol,
故答案为:0.022.
点评 本题考查结构位置性质关系、离子半径的大小比较、元素周期律、热化学方程式书写、离子浓度大小比较、化学图象及化学计算,是对学生综合能力的考查,需要学生具备扎实的基础,难度中等.


 课堂练加测系列答案
课堂练加测系列答案 轻松课堂单元测试AB卷系列答案
轻松课堂单元测试AB卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 等物质的量浓度的下列溶液:①H2CO3 ②Na2CO3 ③NaHCO3 ④(NH4)2CO3其中c(CO32-)的大小关系为:②>④>③>① | |
| B. | pH=2的H2C2O4溶液与pH=12的NaOH溶液等体积混合:c(Na+)+c(H+)=c(OH-)+c( HC2O4-)+c( C2O42-) | |
| C. | 向0.2 mol•L-1NaHCO3溶液中加入等体积0.1 mol•L-1NaOH溶液:c(CO32-)>c(HCO3-)>c(OH-)>c(H+) | |
| D. | 常温下,同浓度的CH3COONa与CH3COOH溶液等体积混合,溶液的pH<7:c(CH3COOH)+c(OH-)>c(Na+)+c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
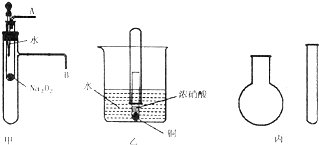 “套管实验”是将一支较小的玻璃仪器装入另一支玻璃仪器中,经组装来完成原来需要较多仪器进行的实验.因其具有许多优点,已被广泛应用于化学实验中.下列三个实验均为“套管实验”,请观察、分析,回答下列问题:
“套管实验”是将一支较小的玻璃仪器装入另一支玻璃仪器中,经组装来完成原来需要较多仪器进行的实验.因其具有许多优点,已被广泛应用于化学实验中.下列三个实验均为“套管实验”,请观察、分析,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
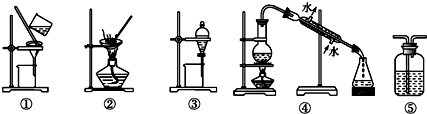
| A. | 用FeCl2溶液吸收Cl2,选⑤ | B. | 分离Na2CO3溶液和油脂,选④ | ||
| C. | 用四氯化碳提取碘水中的碘,选③ | D. | 粗盐提纯,选①和② |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向0.10mol/L NH4HCO3中溶液中通入CO2:c(NH4+)=c(HCO3-)+c(CO32-) | |
| B. | 向0.10mol/L NaHSO3中溶液中通入NH3:c(Na+)>c(NH4+)>c(SO32-) | |
| C. | 向0.10mol/L Na2SO3中溶液中通入SO2:c(Na+)=2[c(H2SO3)+c(HSO3-)+c(SO32-)] | |
| D. | 向0.10mol/L CH3COONa中溶液中通入HCl:c(Na+)>c(CH3COOH)=c(Cl-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
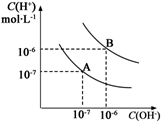 水的电离平衡曲线如图所示:
水的电离平衡曲线如图所示:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com