
| A.-44.2kJ·mol-1 | B.+44.2kJ·mlo-1 | C.-330kJ·mol-1 | D.+330kJ·mlo-1 |
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 N键吸收941kJ热量,则( )
N键吸收941kJ热量,则( )
| A.N4与N2互称为同位素 |
| B.1molN4气体转化为N2时要吸收748kJ能量 |
| C.N4是N2的同系物 |
| D.1molN4气体转化为N2时要放出724kJ能量 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.物质燃烧不一定是放热反应 |
| B.放热反应不需要从外界吸收任何能量就能发生 |
| C.在一个确定的化学反应中,反应物总能量总是高于生成物总能量 |
| D.化学反应除了生成新的物质外,还伴随着能量的变化 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.相同质量的水和冰相比较,冰的能量高 |
| B.化学反应过程中能量的变化只有吸热和放热两种表现形式 |
| C.化学反应既遵循质量守恒,也遵循能量守恒 |
| D.已知C(石墨,s)==C(金刚石,s) ΔH>0,则金刚石比石墨稳定 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

 (2)
(2)


 (4)
(4)
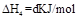
| A.2a=b<0 | B.a<c<0 | C.b>d>0 | D.2c=d>0 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.等物质的量的硫蒸气和硫固体分别完全燃烧,后者放出热量多 |
| B.由C(石墨)= C(金刚石);△H =" +1.90" kJ·mol-1可知,金刚石比石墨稳定 |
| C.在稀溶液中,H+(aq)+ OH-(aq)= H2O(l);△H =" -57.3" kJ·mol-1,若将含0.5 mol H2SO4的浓硫酸与含1 mol NaOH的溶液混合,放出的热大于57.3 kJ |
| D.在101 kPa时,2 g H2完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式表示为:2H2(g)+ O2(g)= 2H2O(l);△H =" -285.8" kJ·mol-1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.该反应是吸热反应 |
| B.断裂1 mol A—A键和1 mol B—B键能放出x kJ的能量 |
| C.断裂2 mol A—B键需要吸收y kJ的能量 |
| D.2 mol AB的总能量高于1 mol A2和1 mol B2的总能量 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.物质发生化学反应时必然伴随着能量变化 |
| B.金属铜导电,故金属铜是电解质 |
| C.自发反应都是熵增大的反应 |
| D.增大反应物浓度,可增大单位体积内活化分子的百分数,从而使反应速率增大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com