
| A、碳酸钙与盐酸反应:CO32-+2H+=H2O+CO2↑ |
| B、稀H2SO4与铁粉反应:Fe+4H+=Fe3++2H2↑ |
| C、氢氧化钡溶液与稀H2SO4反应:Ba2++SO42-=BaSO4↓ |
| D、三氧化二铁与稀盐酸混合:Fe2O3+6H+=Fe3++3H2O |


科目:高中化学 来源: 题型:
| A、根据是否具有丁达尔效应,将分散系分为溶液、浊液和胶体 |
| B、根据水溶液是否导电,将物质分为电解质和非电解质 |
| C、根据是否含氧元素,将物质分为氧化剂和还原剂 |
| D、根据反应中是否有电子转移,将化学反应分为氧化还原反应和非氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
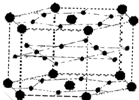 A、B、C、D、E、F六种元素,A、B、C属于第四周期且单质均为固体.基态时,A、B原子核外电子均成对,且核电荷数A>B,原子半径A<B;C与A在周期表属于同一区的元素,原子半径接近.如图是金属B和C所形成的某种合金的晶胞结构示意图;D、E、F在周期表中属于同一区,D原子在基态时p轨道半充满且电负性是同族元素中最大的;E的逐级电离能数据有两次突跃,E原子的第一电离能至第四电离能(kJ/mol)分别为:578、1817、2745、11575;F原子有三个能层,E与F能形成原子数目比为1:3,熔点为190℃的化合物Q.请回答:
A、B、C、D、E、F六种元素,A、B、C属于第四周期且单质均为固体.基态时,A、B原子核外电子均成对,且核电荷数A>B,原子半径A<B;C与A在周期表属于同一区的元素,原子半径接近.如图是金属B和C所形成的某种合金的晶胞结构示意图;D、E、F在周期表中属于同一区,D原子在基态时p轨道半充满且电负性是同族元素中最大的;E的逐级电离能数据有两次突跃,E原子的第一电离能至第四电离能(kJ/mol)分别为:578、1817、2745、11575;F原子有三个能层,E与F能形成原子数目比为1:3,熔点为190℃的化合物Q.请回答:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氧元素的相对原子质量 |
| B、氧元素的一种同位素的近似相对原子质量 |
| C、氧元素的近似相对原子质量 |
| D、氧元素的一种同位素的质量数 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 化学式 | AgCl | Ag2SO4 | Ag2S | AgBr | AgI |
| 溶度积 | 1.8×10-10 | 1.4×10-5 | 6.3×10-50 | 7.7×10-13 | 8.51×10-16 |
| A、25℃时五种银盐的饱和溶液中,c(Ag+)最大的是Ag2SO4溶液 |
| B、25℃时,在等物质的量浓度的NaCl、CaCl2两溶液中加入足量的AgCl固体形成饱和溶液,则两溶液中AgCl的溶度积相同,且两溶液中c(Ag+)也相同 |
| C、在氯化银的悬浊液中加入Na2S溶液可以生成黑色的Ag2S |
| D、AgBr沉淀可以转化成AgI沉淀,而 AgI沉淀在一定条件下也可以转化成AgBr沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、将铁放入氯化铁溶液中:Fe+Fe3+═2Fe2+ |
| B、向新制的氢氧化亚铁中加入足量的稀硝酸:Fe(OH)2+2H+═Fe2++2H2O |
| C、将少量的二氧化硫通入氢氧化钠溶液中:SO2+2OH-═SO32-+H2O |
| D、向氯化铝溶液中加入过量的氢氧化钠溶液:Al3++3OH-═Al(OH)3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、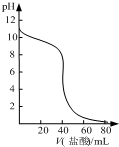 如图表示盐酸滴加到0.1mol/L某碱溶液得到的滴定曲线,用已知浓度盐酸滴定未知浓度该碱时最好选取酚酞作指示剂 |
B、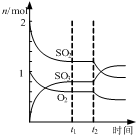 如图表示一定条件下进行的反应2SO2+O2═2SO3各成分的物质的量变化,t2时刻改变的条件可能是缩小容器体积 |
C、 如图表示某明矾溶液中加入Ba(OH)2溶液,沉淀的质量与加入Ba(OH)2溶液体积的关系,在加入20mL Ba(OH)2溶液时铝离子恰好沉淀完全 |
D、 如图表示pH相同的盐酸与醋酸中分别加入水后溶液pH的变化,其中曲线a对应的是盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 催化剂 |
| 高温高压 |
| N≡N | H-H | N-H | |
| 键能/kJ?mol-1 | 945 | 436 | 391 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
| A、原子半径:W>Z>Y>X>M |
| B、XZ2、X2M2、W2Z2均为共价化合物 |
| C、由X元素形成的单质不一定能导电 |
| D、由X、Y、Z、M四种元素形成的化合物一定既有离子键,又有共价键 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com