
【题目】氮的氧化物是大气污染物之一,用活性炭或一氧化碳还原氮氧化物,可防止空气污染。回答下列问题:
已知:2C(s)+O2(g)=2CO(g) ΔH=- 221 kJ/mol
C(s)+O2(g)=CO2(g) △H=- 393.5 kJ/mol
N2(g)+O2(g)=2NO(g) ΔH= +181 kJ/mol
(1)若某反应的平衡常数表达式为K=![]() ,请写出此反应的热化学方程式:___________________________;下列措施能够增大此反应中NO的转化率的是(填字母代号)_________。
,请写出此反应的热化学方程式:___________________________;下列措施能够增大此反应中NO的转化率的是(填字母代号)_________。
a.增大容器压强 b.升高温度 c.使用优质催化剂 d.增大CO的浓度
(2)向容积为2L的密闭容器中加入活性炭(足量)和NO,发生反应C(S)+2NO(g)![]() N2(g)+CO2(g),NO和N2的物质的量变化如下表所示。
N2(g)+CO2(g),NO和N2的物质的量变化如下表所示。
物质的量/mol | T1/℃ | T2/℃ | |||||
0 | 5 min | 10 min | 15 min | 20 min | 15 min | 30 min | |
NO | 2.0 | 1.16 | 0.80 | 0.80 | 0.50 | 0.40 | 0.40 |
N2 | 0 | 0.42 | 0.60 | 0.60 | 0.75 | 0.80 | 0.80 |
①0~5min内,以CO2表示的该反应速率v(CO2)=______,该条件下的平衡常数K=_______________。
②第15 min后,温度调整到T2,数据变化如上表所示,则T1_______ T2(填“>”、“<”或“=”)。
③若30min时,保持T2不变,向该容器中再加入该四种反应混合物各2 mol,则此时反应_______移动(填“正向”、“逆向”或“不”);最终达平衡时NO的转化率a=______________。
(3)工业上可以用氨水除去反应C(s)+2NO(g)![]() N2(g)+CO2(g)中产生的CO2,得到NH4HCO3溶液,反应NH4++HCO3-+H2O
N2(g)+CO2(g)中产生的CO2,得到NH4HCO3溶液,反应NH4++HCO3-+H2O![]() NH3·H2O+H2CO3的平衡常数K=________________。(已知常温下NH3·H2O的电离平衡常数Kb=2×10-5, H2CO3的电离平衡常数Ka1=4×10-7,Ka2=4×10-11)
NH3·H2O+H2CO3的平衡常数K=________________。(已知常温下NH3·H2O的电离平衡常数Kb=2×10-5, H2CO3的电离平衡常数Ka1=4×10-7,Ka2=4×10-11)
【答案】 2CO(g)+2NO(g)![]() N2(g)+2CO2(g) △H=-747 kJ/mol ad 0.042mol·L-1·min-1
N2(g)+2CO2(g) △H=-747 kJ/mol ad 0.042mol·L-1·min-1 ![]() > 正向 60% 1.25×10-3
> 正向 60% 1.25×10-3
【解析】(1)根据平衡常数的定义,若平衡常数表达式为K=![]() ,则化学方程式为:2CO(g)+2NO(g)
,则化学方程式为:2CO(g)+2NO(g)![]() N2(g)+2CO2(g),已知①2C(s)+O2(g)=2CO(g) ΔH=- 221 kJ/mol,
N2(g)+2CO2(g),已知①2C(s)+O2(g)=2CO(g) ΔH=- 221 kJ/mol,
②C(s)+O2(g)=CO2(g) △H=- 393.5 kJ/mol,③N2(g)+O2(g)=2NO(g) ΔH= +181 kJ/mol
根据盖斯定律:②×2-①-③得:2CO(g)+2NO(g)![]() N2(g)+2CO2(g) △H=-747 kJ/mol; 由于该反应是气体体积减小的放热反应a.增大容器压强平衡正向移动NO转化率增大,a正确;b.升高温度平衡逆向移动,NO转化率减小,b错误;c.使用优质催化剂不改变平衡,c错误;d.增大CO的浓度,可以提高NO的转化率,d正确;因此本题答案为:ad。
N2(g)+2CO2(g) △H=-747 kJ/mol; 由于该反应是气体体积减小的放热反应a.增大容器压强平衡正向移动NO转化率增大,a正确;b.升高温度平衡逆向移动,NO转化率减小,b错误;c.使用优质催化剂不改变平衡,c错误;d.增大CO的浓度,可以提高NO的转化率,d正确;因此本题答案为:ad。
(2)根据盖斯定律:上述已知反应②-③得:C(S)+2NO(g)![]() N2(g)+CO2(g) △H=-574.5 kJ/mol;
N2(g)+CO2(g) △H=-574.5 kJ/mol;
①利用表格数据:0~5min内,以N2表示的该反应速率v(N2)=![]() =0.042mol·L-1·min-1所以以CO2表示的该反应速率v(CO2)= v(N2) =0.042mol·L-1·min-1;通过分析知10min后浓度不再改变,处于平衡状态,用三行式分析浓度改变
=0.042mol·L-1·min-1所以以CO2表示的该反应速率v(CO2)= v(N2) =0.042mol·L-1·min-1;通过分析知10min后浓度不再改变,处于平衡状态,用三行式分析浓度改变
C(S)+2NO(g)![]() N2(g)+CO2(g)
N2(g)+CO2(g)
10min时平衡浓度(mol/L) 0.4 0.3 0.3
平衡常数K=![]() =
=![]() =
=![]() 。
。
②第15 min后,温度调整到T2,从表格查得NO减少,N2增加,平衡正向移动,由于正反应为放热反应,改变条件为降温,则T1 >T2。
③若30min时,保持T2不变,向该容器中再加入该四种反应混合物各2 mol,此时各量分析如下: C(S)+2NO(g)![]() N2(g)+CO2(g)
N2(g)+CO2(g)
30min时平衡浓度(mol/L) 0.2 0.4 0.4
加入混合物后浓度(mol/L) 1.2 1.4 1.4
变化浓度(mol/L) 2x x x
新平衡浓度(mol/L) 1.2-2x 1.4+x 1.4+x
T2时平衡常数K=![]() =4, 加入混合物后Qc=
=4, 加入混合物后Qc=![]() =1.36<K,则此时反应正向移动;由于温度不变,平衡常数为定值,新平衡时有:
=1.36<K,则此时反应正向移动;由于温度不变,平衡常数为定值,新平衡时有:![]() =4,解得x=0.2;经计算NO起始总量为2mol+2mol=4mol,达到新平衡时NO的物质的量为(1.2-2×0.2)mol/L×2L=1.6mol,转化的NO共4mol-1.6mol=2.4mol,所以最终达平衡时NO的转化率a=
=4,解得x=0.2;经计算NO起始总量为2mol+2mol=4mol,达到新平衡时NO的物质的量为(1.2-2×0.2)mol/L×2L=1.6mol,转化的NO共4mol-1.6mol=2.4mol,所以最终达平衡时NO的转化率a=![]() 。
。
(3)NH4++HCO3-+H2O![]() NH3·H2O+H2CO3,平衡常数K=
NH3·H2O+H2CO3,平衡常数K=![]() =
=![]() =
=![]() =1.25×10-3。
=1.25×10-3。


科目:高中化学 来源: 题型:
【题目】短周期元素W、X、Y、Z的原子序数依次增加,由这些元素组成的常见物质的转化关系如下图,其中a、b、d、g为化合物,a为淡黄色固体,c是Z的单质,在铝热反应中常做引发剂;e、f为常见气体单质。下列有关说法正确的是
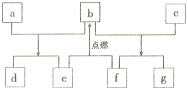
A. 简单离子的半径:Y>Z>X
B. 简单氢化物的沸点:Y>X
C. 最高价氧化物对应水化物的碱性:Z>Y
D. W、Y的氧化物所含化学键类型相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】收藏的清末铝制艺术品至今保存完好,该艺术品未被锈蚀的主要原因是( )
A.铝不易被氧化
B.铝的氧化物在空气中易变成铝
C.铝的密度小,是一种轻金属
D.铝易被氧化,形成的氧化膜有保护作用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列原子或离子的电子排布式或排布图正确的是________(填序号,下同),违反能量最低原理的是____________,违反洪特规则的是________,违反泡利原理的是________。
①Ca2+:1s22s22p63s23p6 ②F-:1s22s23p6
③P:![]() ④Cr:1s22s22p63s23p63d44s2
④Cr:1s22s22p63s23p63d44s2
⑤Fe:1s22s22p63s23p63d64s2 ⑥Mg2+:1s22s22p6⑦C:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(3分)下列与化学概念有关的说法正确的是( )
A. 化合反应均为氧化还原反应
B. 金属氧化物均为碱性氧化物
C. 催化剂能改变可逆反应达到平衡的时间
D. 石油是混合物,其分馏产品汽油为纯净物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化钙(CaO2)在室温下稳定,加热至350℃左右,迅速分解。微溶于水,不溶于乙醇,可溶于稀酸生成过氧化氢。实验室用如下方法制备CaO2并测定其纯度。过氧化钙的制备实验装置和步骤如下:
将盛有H2O2溶液和氨水混合液的三颈烧瓶置于冷水浴中,在搅拌下滴入CaCl2溶液,析出固体CaO2·8H2O。对所得固体过滤,用5mL无水乙醇洗涤2![]() 3次,转移至坩埚于烘箱内105℃下脱水干燥,冷却后称重,得产品CaO2。回答下列问题:
3次,转移至坩埚于烘箱内105℃下脱水干燥,冷却后称重,得产品CaO2。回答下列问题:
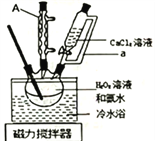
(1)仪器A的名称为:_____________________;恒压分液漏斗的导管a的作用为_________________。
(2)三颈烧瓶中发生反应的化学方程式为___________________________;将三颈烧瓶置于冷水浴中,其主要目的为________________________________。
(3)用无水乙醇代替水洗涤的目的是:___________________________;判断脱水干燥是否完全,需要至少冷却后称重____________次。
(4)过氧化钙纯度的测定,装置如下图所示:
检查装置气密性后,精确称取m g过氧化钙样品加入试管中,调整甲管内液面读数在0-1mL之间,并与乙管的液面相平,记下甲管内液面的初读数V1mL。加热,过氧化钙逐渐分解放出氧气,完全分解,停止加热冷却至室温后,使甲乙两管的液面相平,记下甲管内液面的终读数V2mL,设在此温度和压强下气体摩尔体积为VmL·mol-1,则样品中CaO2的质量分数为___________%。
(5)过氧化钙用于长途运输鱼苗,可能的原因是____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图中的曲线分别表示元素的某种性质与核电荷数的关系(Z为核电荷数,Y为元素的有关性质):
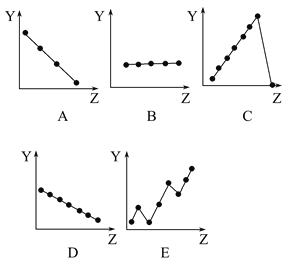
把与元素有关性质相符的曲线的标号填入相应括号中:
(1)ⅡA族元素原子的价电子数___________;
(2)第三周期元素的最高正化合价___________;
(3)F-、Na+、Mg2+、Al3+四种离子的离子半径___________;
(4)第二周期元素的原子半径(不包括稀有气体) ___________;
(5)第二周期元素的第一电离能 ___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于钠的叙述中,不正确的是( )
A.钠是银白色金属、有金属光泽B.钠的密度比水大比煤油小
C.钠具有很强的还原性D.钠燃烧时生成淡黄色固体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用于金属焊接的某种焊条,其药皮由大理石、水泥、硅铁等配制而成。
(1)Al的原子结构示意图为________;Al与NaOH溶液反应的离子方程式为_________________________________________________________________。
(2)30Si原子的中子数为________;SiO2的晶体类型为________。
(3)Al3+与Yn-的电子数相同,Y所在族各元素的氢化物的水溶液均显酸性,则该族氢化物中沸点最低的是________。
(4)焊接过程中,药皮在高温下产生了熔渣和使金属不被氧化的气体,该气体是________。
(5)经处理后的熔渣36.0 g(仅含Fe2O3、Al3O3、SiO2),加入足量稀盐酸,分离得到11.0 g固体;滤液中加入过量NaOH溶液,分离得到21.4 g固体;则此熔渣中Al2O3的质量分数为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com