
| A. | Cl2通入水中:Cl2+H2O═2H++Cl-+ClO- | |
| B. | 向明矾溶液中滴加Ba(OH)2溶液,恰好使SO42-沉淀完全:2Al3++3SO42-+3Ba2++6OH-═2Al(OH)3↓+3BaSO4↓ | |
| C. | 用CH3COOH溶解CaCO3:CaCO3+2H+═Ca2++H2O+CO2↑ | |
| D. | Ca(HCO3)2溶液与少量NaOH溶液反应:HCO3-+Ca2++OH-═CaCO3↓+H2O |
分析 A.次氯酸为弱电解质,保留化学式;
B.硫酸根离子恰好沉淀时,铝离子与氢氧根离子的物质的量之比为1:4,二者反应生成偏铝酸根离子;
C.醋酸为弱电解质,应保留化学式;
D.Ca(HCO3)2溶液与少量NaOH溶液反应生成碳酸钙和碳酸氢钠.
解答 解:A.Cl2通入水中与水反应生成氯化氢和次氯酸,离子方程式:Cl2+H2O═H++Cl-+HClO,故A错误;
B.明矾[KAl(SO4)2]溶液中滴入Ba(OH)2溶液使SO42-恰好完全沉淀,硫酸铝钾与氢氧化钡的物质的量之比为1:2,反应生成偏铝酸钠,正确的离子方程式为:2Ba2++4OH-+Al3++2SO42-═2BaSO4↓+AlO2-+2H2O,故B错误;
C.用CH3COOH溶解CaCO3离子方程式:CaCO3+2CH3COOH═2CH3COO-+Ca2++H2O+CO2↑,故C错误;
D.Ca(HCO3)2溶液与少量NaOH溶液反应,离子方程式:HCO3-+Ca2++OH-═CaCO3↓+H2O,故D正确;
故选:D.
点评 本题考查了离子方程式的判断,掌握离子方程式的书写原则,明确离子方程式正误判断常用方法是解题关键,注意化学式的拆分,题目难度不大.


科目:高中化学 来源: 题型:解答题
主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 一 | ① | |||||||
| 二 | ② | ③ | ④ | |||||
| 三 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ |
 ,⑦元素的名称是硅,⑨元素的离子的电子式是
,⑦元素的名称是硅,⑨元素的离子的电子式是 ,②的最简单气态氢化物中的化学键有极性键(填“离子键”、“极性键”或“非极性键”).
,②的最简单气态氢化物中的化学键有极性键(填“离子键”、“极性键”或“非极性键”). .用电子式表示⑤与⑧形成化合物的形成过程
.用电子式表示⑤与⑧形成化合物的形成过程 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
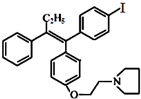 (不考虑立体结构).M的新旧二条合成路线如下:
(不考虑立体结构).M的新旧二条合成路线如下:



 D
D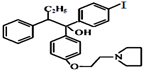
 有多种同分异构体,其中满足①遇FeCl3显色②苯环上的一溴取代物只有一种,符合条件的同分异构体数目有多少种.6任写其中一种的结构简式.
有多种同分异构体,其中满足①遇FeCl3显色②苯环上的一溴取代物只有一种,符合条件的同分异构体数目有多少种.6任写其中一种的结构简式. 中任一种
中任一种 +
+ $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$ +HBr
+HBr 及含二个碳原子的有机化合物为原料,制备芳香醇
及含二个碳原子的有机化合物为原料,制备芳香醇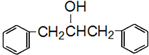 的合成路线(不超过5步反应).
的合成路线(不超过5步反应).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10ml 0.2mol/L的FeCl3溶液 | B. | 10ml 0.1mol/L的AlCl3溶液 | ||
| C. | 20ml 0.1mol/L的溶MgCl2液 | D. | 20ml 0.1mol/L的HCl溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 除氢元素外,非金属元素都在p区,d区元素全部是金属.
除氢元素外,非金属元素都在p区,d区元素全部是金属.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:1000 | B. | 1:100 | C. | 1:10 | D. | 1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入适量的5mol•L-1的硫酸 | B. | 加入少量醋酸钠固体 | ||
| C. | 加热 | D. | 加入少量金属钠 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | A是固体,C是气体,正反应吸热 | B. | A是气体,C是液体,正反应放热 | ||
| C. | A是气体,C是气体,正反应放热 | D. | A是气体,C是气体,正反应吸热 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com