
分析 汽化或熔化时,一般分子晶体克服分子间作用力,原子晶体克服共价键;离子晶体克服离子键;熔沸点的一般规律:原子晶体>离子晶体>分子晶体,以此来解答.
解答 解:氢氧化钠属于离子晶体,熔化时,微粒间克服的作用力是离子键;干冰属于分子晶体,升华时,微粒间克服的作用力是分子间作用力;晶体硅属于原子晶体,熔化时,微粒间克服的作用力是共价键.三种晶体熔沸点由低到高的顺序是:干冰<氢氧化钠<晶体硅;
故答案为:离子键;分子间作用力;共价键;干冰<氢氧化钠<晶体硅.
点评 本题以微粒间作用力为载体考查晶体类型,侧重考查学生对这几种晶体类型的判断能力,注意不同晶体中的化学键及分子晶体中存在分子间作用力的判断,难度不大.


科目:高中化学 来源: 题型:解答题
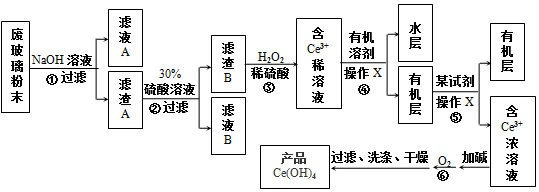
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 溶质 | NaHCO3 | Na2CO3 | NaCN |
| pH | 9.7 | 11.6 | 11.1 |
| A. | 阳离子的物质的量浓度之和:Na2CO3>NaCN>NaHCO3 | |
| B. | 相同条件下的酸性:H2CO3<HCN | |
| C. | 三种溶液中均存在电离平衡和水解平衡 | |
| D. | 向0.2 mol•L-1NaHCO3溶液中加入等体积0.1 ol•L-1 NaOH溶液:c(CO32-)>c(HCO3-)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 需要称量NaClO固体的质量为144.0 g | |
| B. | 如图所示的仪器中,有四种是不需要的,另外还需一种玻璃仪器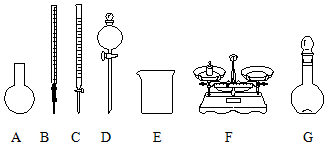 | |
| C. | 配制的溶液在空气中光照,久置后溶液中NaClO的物质的量浓度减小 | |
| D. | 容量瓶用蒸馏水洗净后应烘干才能用于溶液配制,否则结果偏低 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,7.8g苯中含有的碳碳双键数是0.3NA | |
| B. | 标准状况下,11.2L四氯甲烷所含分子数为0.5NA | |
| C. | 常温常压下,14g乙烯分子中含有的碳碳键数目为2NA | |
| D. | 1mol氢氧根离子(OH-)所含电子数为10NA |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| T/K | 303 | 313 | 323 |
| n(NH3)/(l0-2 mol) | 4.8 | 5.9 | 6.0 |
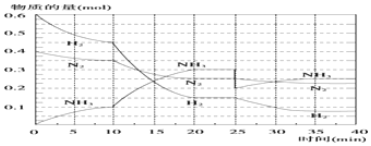
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com