
下列有关物质分类或归类正确的一组是
①化合物:CaCl2、NaOH、HCl、HD ②混合物:盐酸、漂白粉、水玻璃、水银
③同素异形体:C60、金刚石、石墨 ④电解质:氯化铵、硫酸钡、冰醋酸
A.①② B.①③ C.②③ D.③④
科目:高中化学 来源:2014-2015吉林省吉林市高一上学期期末考试化学试卷(解析版) 题型:选择题
下列除去括号内杂质的方法错误的是
A.SiO2( Al2O3):加NaOH溶液后过滤 B.Br2(CCl4):蒸馏
C.FeCl2(FeCl3):加铁屑后过滤 D.CO(CO2):用NaOH溶液洗气
查看答案和解析>>
科目:高中化学 来源:2014-2015湖南省长沙市望城区高一上学期期末化学试卷(解析版) 题型:选择题
下列气体有颜色和有刺激性气味的是
A.CO2 B.Cl2 C.O2 D.CO
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省青岛市高三上学期期末考试化学试卷(解析版) 题型:填空题
(14分)已知有A、B、C、D、E五种短周期元素元素,其原子序数依次增大。F是常见的金属,在潮湿的空气中被腐蚀形成红棕色固体。A、C同主族,A与B、A与E形成共价化合物,A与B形成化合物的水溶液呈碱性,E元素的最高正价与最低负价的代数和为6,D是同周期中离子半径最小的元素。
(1)五种元素中,金属性最强的元素在周期表的位置是________写出D元素的原子结构示意图________
(2)B元素的气态氢化物与其最高价氧化物对应的水化物化合,生成物的水溶液呈___性,原因________(离子方程式表示)上述化合物浓溶液滴加到Mg(OH)2悬浊液中,沉淀逐渐消失最后澄清,请解释澄清的原因______________________________________________
(3)含F的二价离子的酸性溶液,在空气中易被氧化变质,该过程的离子反应为:____________________
检验该二价离子没有被完全氧化的方法为:_______________________________
(4).E元素的最高价氧化物对应的水化物与D元素的最高价氧化物对应的水化物反应的化学方程式为____________________________________________________
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省青岛市高三上学期期末考试化学试卷(解析版) 题型:选择题
以下关于下图说法正确的是
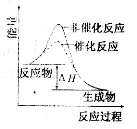
A.图表明催化剂可以改变反应的热效应
B.图表示某反应能量的变化与生成物状态无关
C.图表示某吸热反应分别在有、无催化剂的情况下反应过程中的能量变化
D.图表明化学反应不仅遵循质量守恒定律,也遵循能量守恒
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省青岛市高三上学期期末考试化学试卷(解析版) 题型:选择题
化学与生活密切相关,下列说法正确的是
A.含有是食品添加剂的食物对人体健康均有害
B.普通玻璃和氮化硅陶瓷都属于新型无机非金属材料
C.大力推广应用燃料“脱硫、脱硝”技术,可减少硫氧化物和氮氧化物对空气的污染
D.为消除碘缺乏病,政府规定在食盐中必须添加一定量的KI
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省莱芜市高三1月月考化学试卷(解析版) 题型:选择题
室温时,关于下列溶液的叙述正确的是
A.1.0×10—3mol/L盐酸的pH=3,1.0×10—8mol/L盐酸的pH=8
B.pH=a的醋酸溶液稀释l倍后,溶液的pH=b,则a>b
C.pH=12的氨水和pH=2的盐酸等体积混合,混合液的pH<7
D.1mLpH=l的盐酸与100mLNaOH溶液混合后,溶液的pH=7,则NaOH溶液的pH=11
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省高三上学期12月月考理综化学试卷(解析版) 题型:实验题
(19分) Na2S2O3可以用作氰化物的解毒剂,工业上常用硫化碱法制备Na2S2O3,反应原理为:2Na2S+Na2CO3+4SO2==3Na2S2O3+CO2,某研究小组在实验室模拟该工业原理制备Na2S2O3,实验装置如下:

Ⅰ.实验步骤:
(1)检查装置气密性,按图示加入试剂。仪器a的名称是_________________;
(2)先向C中烧瓶加入Na2S和Na2CO3混合溶液,再向A中烧瓶滴加浓H2SO4。
(3)待Na2S和Na2CO3完全消耗后,结束反应。过滤C中混合物,滤液经____________(填写操作名称)、过滤、洗涤、干燥,得到产品。
Ⅱ.[探究与反思]
(1)装置D的作用是检验装置C中SO2的吸收效率,则B中试剂是 ,表明SO2吸收效率低的实验现象是B中溶液 。
(2)实验制得的Na2S2O3?5H2O样品中可能含有Na2SO3、Na2SO4等杂质。利用所给试剂设计实验,检测产品中是否存在Na2SO4,简要说明实验操作,现象和结论: 。
已知Na2S2O3?5H2O遇酸易分解:S2O32?+2H+=S↓+SO2↑+H2O
供选择的试剂:稀盐酸、稀硫酸、稀硝酸、BaCl2溶液、AgNO3溶液
(3)为减少装置A中生成的Na2SO4的量,在不改变原有装置的基础上对原有实验步骤(2)进行了改进,改进后的操作是____________________。
Ⅲ.测定产品纯度
准确称取W g产品,用适量蒸馏水溶解,以淀粉作指示剂,用0.100 0 mol·L-1碘的标准溶液滴定。
反应原理为2S2O32?+I2=== S4O62?+2I-
(1)滴定至终点时,溶液颜色的变化:___________________。
(2)滴定起始和终点的液面位置如图,则消耗碘的标准溶液体积为__________mL。产品的纯度为(设Na2S2O3·5H2O相对分子质量为M)______________。

查看答案和解析>>
科目:高中化学 来源:2014-2015陕西省西安市高二上学期期末化学试卷(解析版) 题型:选择题
高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为:

下列叙述不正确的是
A.放电时负极反应为:Zn - 2e— + 2OH— == Zn(OH)2
B.充电时阳极反应为:Fe(OH)3 -3e— + 5OH— == FeO42— + 4H2O
C.放电时每转移3moL电子,正极有1 mol K2FeO4被氧化
D.放电时正极附近溶液的碱性增强
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com