
| 3 |
| 4 |
| 3 |
| 4 |
| 3 |
| 4 |
| 3 |
| 4 |
| 0.2mol |
| 0.4mol |
| 42 |
| 2×63 |
| 1 |
| 27 |
| 82 |
| 8×63 |
| 1 |
| 27 |
| 1 |
| 27 |


科目:高中化学 来源: 题型:
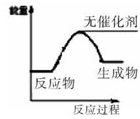 联合国气候变化大会于2009年12月7-18日在哥本哈根召开.中国政府承诺,到2020年,单位GDP 二氧化碳排放比2005年下降40%-45%.
联合国气候变化大会于2009年12月7-18日在哥本哈根召开.中国政府承诺,到2020年,单位GDP 二氧化碳排放比2005年下降40%-45%.
| ||
| ||
| ||
| 太阳光 |
| 高温 |
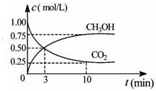
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
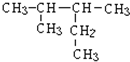 系统命名法命名的名称是
系统命名法命名的名称是查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
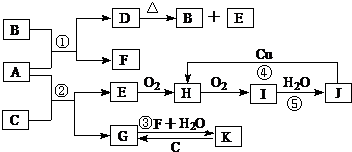
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氯化铁溶液与氢氧化钠溶液反应:Fe3++3OH-=Fe(OH)3↓ |
| B、氯化铝溶液通入过量氨水:Al3++4OH-→AlO2-+2H2O |
| C、碳酸氢钠溶液与盐酸:HCO3-+H+=H2O+CO2↑ |
| D、钠投入水中:2Na+2H+→2Na++H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、将1mol NH4NO3溶于一定浓度的稀氨水中,溶液呈中性,溶液中一定含有NA个NH4+ |
| B、t℃时,MgCO3的KSP=4×10-6,则饱和溶液中含Mg2+数目为2×10-3NA |
| C、10g质量分数为46%的乙醇水溶液中,氢原子的总数为1.2NA |
| D、标准状况下,含有1mol硫原子的SO2与SO3的混合物,其体积小于22.4L |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向某物质中滴加盐酸后,有能使澄清石灰水变浑浊的无色无味气体产生,证明含CO32- |
| B、向某溶液中滴加氯化钡溶液,产生白色沉淀,再滴加足量稀硝酸,依然有白色固体,说明原溶液含有SO42- |
| C、向某溶液中逐渐滴加NaOH溶液,先有白色胶状沉淀产生,后来沉淀逐渐溶解,则原溶液中可能含有Al3+ |
| D、向某溶液中先加入氯水,再滴入KSCN溶液,最后溶液显血红色,则原溶液中一定含有Fe3+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com