
| ʱ�䣨s�� | 0 | 1 | 2 | 3 | 4 | �� |
| c��NO��/mol•L-1 | 1.00��10-3 | 4.00��10-4 | 1.70��10-4 | 1.00��10-4 | 1.00��10-4 | �� |
���� ��1�����ݱ������������ǰ2s�ڵ�ƽ����Ӧ���ʦԣ�NO��=��1.00��10-3-1.70��10-4 ����2=4.15��10-4mol/��L•s�������ݻ�ѧ��Ӧ����֮�ȵ��ڻ�ѧ������֮�ȣ��ԣ�N2��=1/2�ԣ�NO��=2.08��10-4 mol/��L•s�����ɱ������ݿ�����3s��c��NO���������ƽ�⣬��ʱc��CO��=1.00��10-4mol•L-1��c��CO2��=1.00��10-3mol•L-1 -1.00��10-4mol•L-1=9.00��10-4mol•L-1��c��N2��=1/2c��CO2��=4.50��10-4mol•L-1������K=c��CO2��2��c��N2��/��c��NO��2��c��CO��2��=3.65��106��
��2���ﵽƽ��ʱ��Ҫ���NOת���ʣ����ı�����Ҫʹƽ�������ƶ���
A��ѡ�ø���Ч�Ĵ�����ƽ�ⲻ�ƶ�����A����
B�����ͷ�Ӧ��ϵ���¶ȣ��÷�ӦΪ���ȷ�Ӧ�������ƶ�����B��ȷ��
C���������ʹ������ѹǿ����ƽ�ⲻ�ƶ�����C����
D������COʹ������ѹǿ�����൱������COŨ�ȣ�ƽ�������ƶ���NOת������ߣ���D��ȷ��
��3������֪���̢�2NO��g��+2CO��g��=2CO2��g��+N2��g����H=-748kJ/mol����N2��g��+O2��g��=2NO��g����H=+180kJ/mol�����ݸ�˹���ɢ١�2+�ڡ�2��CO��ȼ���ȵ��Ȼ�ѧ����ʽΪCO��g��+1/2O2��g��=CO2��g����H=��-748kJ/mol����2+��+180kJ/mol����2=-284 kJ/mol��
��4��O3����NO���ˮϴ�ɲ���HNO3��O2��ת�Ƶ�����=���ϼ���������NOת��ΪHNO3 �����ϼ�����3��ÿ����1mol��HNO3ת��3mol����
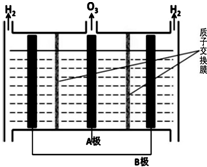
��5��������֪ͼ��A����������O3��B����������H2��˵��A��������������ӦΪ������B��������ԭ��ӦΪ���������������Ե缫���ĵ缫��ӦʽΪ3H2O-6e-=O3+6H+
��� ���1�����ݱ������������ǰ2s�ڵ�ƽ����Ӧ���ʦԣ�NO��=��1.00��10-3-1.70��10-4 ����2=4.15��10-4mol/��L•s�������ݻ�ѧ��Ӧ����֮�ȵ��ڻ�ѧ������֮�ȣ��ԣ�N2��=1/2�ԣ�NO��=2.08��10-4 mol/��L•s�����ɱ������ݿ�����3s��c��NO���������ƽ�⣬��ʱc��CO��=1.00��10-4mol•L-1��c��CO2��=1.00��10-3mol•L-1 -1.00��10-4mol•L-1=9.00��10-4mol•L-1��c��N2��=1/2c��CO2��=4.50��10-4mol•L-1������K=c��CO2��2��c��N2��/��c��NO��2��c��CO��2��=3.65��106��
�ʴ�Ϊ��2.08��10-4 mol/��L•s����3.65��106��
��2���ﵽƽ��ʱ��Ҫ���NOת���ʣ����ı�����Ҫʹƽ�������ƶ���
A��ѡ�ø���Ч�Ĵ�����ƽ�ⲻ�ƶ�����A����
B�����ͷ�Ӧ��ϵ���¶ȣ��÷�ӦΪ���ȷ�Ӧ�������ƶ�����B��ȷ��
C���������ʹ������ѹǿ����ƽ�ⲻ�ƶ�����C����
D������COʹ������ѹǿ�����൱������COŨ�ȣ�ƽ�������ƶ���NOת������ߣ���D��ȷ��
�ʴ�Ϊ��BD��
��3������֪���̢�2NO��g��+2CO��g��=2CO2��g��+N2��g����H=-748kJ/mol����N2��g��+O2��g��=2NO��g����H=+180kJ/mol�����ݸ�˹���ɢ١�2+�ڡ�2��CO��ȼ���ȵ��Ȼ�ѧ����ʽΪCO��g��+1/2O2��g��=CO2��g����H=��-748kJ/mol����2+��+180kJ/mol����2=-284 kJ/mol��
�ʴ�Ϊ��284 kJ/mol���H=-284kJ/mol��
��4��O3����NO���ˮϴ�ɲ���HNO3��O2��ת�Ƶ�����=���ϼ���������NOת��ΪHNO3 �����ϼ�����3��ÿ����1mol��HNO3ת��3mol����
��5��������֪ͼ��A����������O3��B����������H2��˵��A��������������ӦΪ������B��������ԭ��ӦΪ���������������Ե缫���ĵ缫��ӦʽΪ3H2O-6e-=O3+6H+��
�ʴ�Ϊ��3H2O-6e-=O3+6H+��
���� ���⿼���˷�Ӧ���ʡ�ƽ�ⳣ����ת���ʵļ��㣬��Ӧ�����仯�ķ����жϺ��Ȼ�ѧ����ʽ����д����ѧƽ���Ӱ�����ط���Ӧ�ã�ƽ�ⳣ�����㣬�缫����ʽ����д�ȣ����ջ����ǽ���ؼ�����Ŀ�Ѷ��еȣ�


 ��ѧȫ��������ѵ��ϵ�д�
��ѧȫ��������ѵ��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
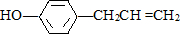 ��������˵������ȷ���ǣ�������
��������˵������ȷ���ǣ�������| A�� | �û��������ڷ����� | |
| B�� | ������������7��̼ԭ�Ӵ���ͬһ��ƽ�� | |
| C�� | ���IJ���ͬ���칹������̼��������Һ��Ӧ�������� | |
| D�� | 1mol�û�����������2molBr2������Ӧ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | NaCl��MgCl2��Na2O | B�� | H2O��Na2O��CO2 | ||
| C�� | CaCl2��NaOH��H2SO4 | D�� | NH4Cl��H2O��CO2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | Ԫ��Y��Q���γɻ�����Y2Q3 | |
| B�� | T��Z����һ�ֵ��ʵĿռ乹��Ϊ���������� | |
| C�� | X��Q������ɵĻ�����Ϊ���ӻ����� | |
| D�� | ZO2�Ǽ��Լ����ɵķǼ��Է��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ���ṹʽ��O=C=O��
���ṹʽ��O=C=O�� ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ��ҩ������ҽѧ��Խ��Խ�ܵ���ע����ҩҩ����˪����Ҫ�ɷ�As2O3�����������Ƽ���Ѫ����Ϊ�ˣ��鼰�仯�������ȡ�ٴ������ע��
��ҩ������ҽѧ��Խ��Խ�ܵ���ע����ҩҩ����˪����Ҫ�ɷ�As2O3�����������Ƽ���Ѫ����Ϊ�ˣ��鼰�仯�������ȡ�ٴ������ע�� �����������ڱ��е�λ���ǵ������ڣ�VA�壮
�����������ڱ��е�λ���ǵ������ڣ�VA�壮
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
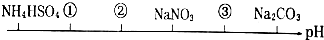
| A�� | NH4Cl ��NH4��2SO4 CH3COONa | B�� | ��NH4��2SO4 NH4Cl CH3COONa | ||
| C�� | ��NH4��2SO4 NH4Cl NaOH | D�� | CH3COOH NH4Cl ��NH4��2SO4 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com