
��ҵ��һ����CO��H2Ϊԭ�Ϻϳɼ״����÷�Ӧ���Ȼ�ѧ����ʽΪ��
CO ( g ) + 2H2 ( g )  CH3OH ( g ) ��H=-116kJ/mol
CH3OH ( g ) ��H=-116kJ/mol
��1���÷�Ӧ�Ļ�ѧƽ�ⳣ������ʽΪ ��
��2�����д�ʩ������������÷�Ӧ�ķ�Ӧ���������ת���ʵ��� (����ĸ���) ��
a����ʱ��CH3OH�뷴Ӧ�������� b�����ͷ�Ӧ�¶�
c��ʹ�ø�Ч���� d��������ϵѹǿ
(3)һ�������£���1 mol CO��3 mol H2�Ļ�������ڴ��������·�����Ӧ���ɼ״���ƽ����������ݻ�ѹ����ԭ����l/2�������������䣬��ƽ����ϵ������Ӱ���� (����ĸ���)��
a��c ( H2 )���� b������Ӧ���ʼӿ죬�淴Ӧ���ʼ���
c��CH3OH �����ʵ������� d������ƽ��c ( H2 )/ c (CH3OH )��С
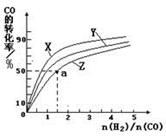
��4�� ���ܱ������г���1mol CO��2 mol H2���ڴ��������·�Ӧ���ɼ״���CO��ת����(��)���¶�(T)��ѹǿ(P)�Ĺ�ϵ��ͼ��ʾ��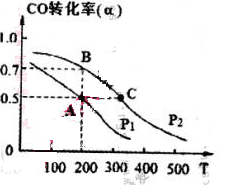
��A��C���㶼��ʾ�ﵽ��ƽ��״̬�����Է�Ӧ��ʼ����ƽ��״̬�����ʱ�䣬tA tC(����ڡ�����С�ڡ�������")��
����A��ʱ���������Ϊ1 L�����¶���B���ƽ�ⳣ�� K= ��
��1��[CH3OH] / [ CO][H2]2 ��2��d ��3��cd ��4���ٴ��� �� 1 L2��mol��2
���������������Ϸ���ʽ���ѵ�֪����������Ӧ�����������ת���ʵķ���Ϊ������ϵѹǿ����3�����������ݻ�ѹ���ᵼ��ƽ�������ƶ�������c��d��ȷ����4����ΪC����¶ȸߣ����Է�Ӧ���ʿ죻����A��ʱCO��ת���ʣ����ƽ�ⳣ������ʽ����K=1 L2��mol��2����B����A��ͬ�¶ȣ�����K��ͬ��
���㣺��ѧƽ����ƶ�����ѧƽ�ⳣ���ļ��㡣


 �������ͬ������ϵ�д�
�������ͬ������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�����仯�������������������й㷺Ӧ�á���ش��������⣺
��1��ˮ�ȷ��Ʊ�Fe3O4�������ķ�Ӧ�ǣ�3Fe2����2S2O32-��O2��xOH����Fe3O4����S4O32-��2H2O
���������ӷ���ʽ��x��________��
��ÿ����1 mol Fe3O4����Ӧת�Ƶĵ���Ϊ________mol��
��2��ij��Ч��ˮ������Fe��OH��SO4�ۺϵõ�����ҵ����FeSO4��NaNO2��ϡ����Ϊԭ�����Ʊ�Fe��OH��SO4����Ӧ����NO���ɣ���ѧ����ʽΪ����������������
��¯���������з�������Ҫ��ӦΪ��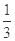 Fe2O3��s��+ CO��g��
Fe2O3��s��+ CO��g�� 
 Fe��s��+CO2��g��+Q
Fe��s��+CO2��g��+Q
��֪�÷�Ӧ�ڲ�ͬ�¶��µ�ƽ�ⳣ�����£�
| �¶�/�� | 1000 | 1115 | 1300 |
| ƽ�ⳣ�� | 4.0 | 3.7 | 3.5 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��1����������Ĵ������Ĺ�����ͼ��ʾ������a��c�����Ļ�ѧ����ʽ�ɱ�ʾΪ��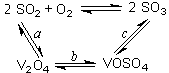
SO2+V2O5 SO3+ V2O4
SO3+ V2O4
4VOSO4+O2 2V2O5+4SO3��
2V2O5+4SO3��
�÷�Ӧ�Ĵ����� ��д��ѧʽ��
��2�� 550 ��ʱ��SO2ת��ΪSO3��ƽ��ת���ʣ���������ϵ��ѹǿ��p���Ĺ�ϵ��ͼ��ʾ����2��0 mol SO2��1��0 mol O2����5 ���ܱ������У���Ӧ��ƽ�����ϵ��ѹǿΪ0��10 M Pa���Լ��㷴Ӧ2SO3 2SO2+O2��550 ��ʱ��ƽ�ⳣ��K= ��
2SO2+O2��550 ��ʱ��ƽ�ⳣ��K= ��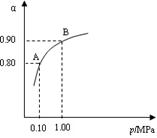
��3��550 ��ʱ����2��0 mol SO2��1��0 mol O2����5 ���ܱ������У���Ӧ ��ƽ������д�ʩ����ʹn(SO3)/n(SO2)�������
A�������¶�
B������He(g)��ʹ��ϵ��ѹǿ����
C���ٳ���2 mol SO2��1 mol O2
D���ٳ���1 mol SO2��1 mol O2
��4��ά���¶Ȳ���������ʹ֮�������·�Ӧ��2SO2��O2 2SO3������ֻ�ܱ�����A��B��A������һ�������ƶ��Ļ�����ʹ�����ڱ��ֺ�ѹ��B�����ܱ��ֺ��ݡ���ʼʱ�������������зֱ��������ʵ����������Ϊ2��1��SO2��O2�Ļ�����壬��ʹA��B�ݻ���ȣ�����ͼ��ʾ����
2SO3������ֻ�ܱ�����A��B��A������һ�������ƶ��Ļ�����ʹ�����ڱ��ֺ�ѹ��B�����ܱ��ֺ��ݡ���ʼʱ�������������зֱ��������ʵ����������Ϊ2��1��SO2��O2�Ļ�����壬��ʹA��B�ݻ���ȣ�����ͼ��ʾ����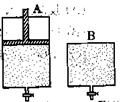
����д���пո�
A�����ﵽƽ��ʱ�����ʱ���B����__________������̻�����ƽ��ʱA������SO2��ת���ʱ�B����_______��������С�������ﵽ����ƽ���������������ͨ������ʵ�����ԭ��Ӧ���壬�ﵽƽ��ʱ��A�����Ļ��������SO3���������_________�����������С�����䡱����ͬ����B�����Ļ��������SO3���������_________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��ͼ��ʾ��B�л����������ɻ�����A��B�о���1mol X��1mol Y����ʼʱ��V(A)��V(B)��a L���ر�K����ͬ�¶��£���������ͬʱ������Ӧ��2X(g)��2Y(g) Z(g)��2W(g) ��H��0���ﵽƽ�⣨��ʱ��V(B)��0.8a L��
Z(g)��2W(g) ��H��0���ﵽƽ�⣨��ʱ��V(B)��0.8a L��
��1���ﵽƽ�������ʱ�䣺A B�����>������<������=������ͬ��
��2��W�İٷֺ�����A B��
��3��B��X��ת����Ϊ ��
��4����K�����´�ƽ�⣨��ʱ��B�����Ϊ L���ú�a��ʽ�ӱ�ʾ����ͨ��������Բ��ƣ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�����û�ѧ��Ӧԭ�������֪ʶ�о�̼���仯��������ʡ�
��1����ҵ��һ����CO��H2Ϊԭ�Ϻϳɼ״����ں��������У��÷�Ӧ���Ȼ�ѧ����ʽΪ��
CO(g)��2H2(g)  CH3OH(g)����H1����116 kJ��mol��1
CH3OH(g)����H1����116 kJ��mol��1
�����д�ʩ����˵����Ӧ�ﵽƽ��״̬����___________
| A����ϵѹǿ���ֲ��� |
| B�����������ܶȱ��ֲ��� |
| C��CO��H2��Ũ��֮��Ϊ1��2 |
| D����λʱ���ڣ�����2molH2��ͬʱ����1mol CH3OH |
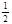 O2(g)=CO2(g) ��H2����283 kJ��mol-1 H2(g)+
O2(g)=CO2(g) ��H2����283 kJ��mol-1 H2(g)+  O2(g)=H2O(g) ��H3����242 kJ��mol-1
O2(g)=H2O(g) ��H3����242 kJ��mol-1�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�跴Ӧ��Fe(s)+CO2(g) FeO(s)+CO(g)��H=Q1��ƽ�ⳣ��ΪK1��
FeO(s)+CO(g)��H=Q1��ƽ�ⳣ��ΪK1��
��Ӧ��Fe(s)+H2O(g) FeO(s)+H2(g)��H=Q2��ƽ�ⳣ��ΪK2���ڲ�ͬ�¶��£�K1��K2��ֵ���£�
FeO(s)+H2(g)��H=Q2��ƽ�ⳣ��ΪK2���ڲ�ͬ�¶��£�K1��K2��ֵ���£�
| �¶�(T) | K1 | K2 |
| 973 | 1��47 | 2��38 |
| 1173 | 2��15 | 1��67 |
 CO(g)+H2O(g)��H=Q3
CO(g)+H2O(g)��H=Q3�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
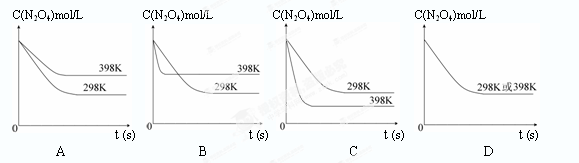
���¶�Ϊ298Kʱ����0.10 mol��ɫ��N2O4�������1L��յ��ܱ������У����ֺ���ɫ��ֱ������N2O4(g) 2NO2(g)��ƽ�⡣��ͼ��ʾ�ⶨN2O4��Ũ����ʱ���ϵ�����ߣ�������ΪN2O4��Ũ�ȣ�������Ϊʱ�䣩��
2NO2(g)��ƽ�⡣��ͼ��ʾ�ⶨN2O4��Ũ����ʱ���ϵ�����ߣ�������ΪN2O4��Ũ�ȣ�������Ϊʱ�䣩��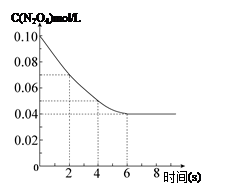
|
| T/K | 310 | 320 |
| Kֵ | 0.38 | 0.42 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�ô�����̼��Ƹ�ϡ���ᷴӦ��ȡ������̼���壬��ش�
��1��ʵ���������ͼ��ʾ�������жϣ� �λ�ѧ��Ӧ������죬 ���ռ��Ķ�����̼��ࡣ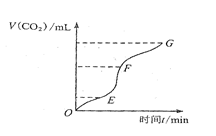
��2��Ϊ�˼���������ѧ��Ӧ�����ʣ�������Һ�м����������ʣ�����Ϊ���е��ǣ� ��
| A������ˮ | B��NaCl���� | C��NaCl��Һ | D��Ũ���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�ҹ��зḻ����Ȼ����Դ������Ȼ��Ϊԭ�Ϻϳ����ص���Ҫ��������ͼ��ʾ��ͼ��ijЩת�����輰������δ�г�����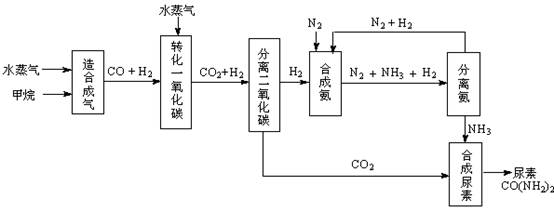
��1������ϳ������������Ȼ�ѧ����ʽ��CH4(g)+H2O(g) 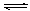 CO(g)+3H2(g)����H��0
CO(g)+3H2(g)����H��0
�ں��º��ݵ������£������CH4�ķ�Ӧ���ʺ�ת���ʣ����д�ʩ���е��� ��
A������ѹǿ B�������¶� C������He�� D������ˮ����Ũ��
��2����ת��һ����̼�������ķ���ʽ��H2O(g) +CO(g) 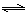 H2(g)+CO2(g)���÷�Ӧƽ�ⳣ�����¶ȵı仯���£�
H2(g)+CO2(g)���÷�Ӧƽ�ⳣ�����¶ȵı仯���£�
| �¶�/�� | 400 | 500 | 800 |
| ƽ�ⳣ��K | 9.94 | 9 | 1 |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com