
【题目】下图是部分短周期元素的单质及化合物(或其溶液)的转化关系(部分反应条件已省略),其中A、B是单质,A的焰色反应为黄色,C、D是化合物,其它物质已经给出化学式,依据转化关系回答下列问题(出现A、B、C、D请用元素符号表示):
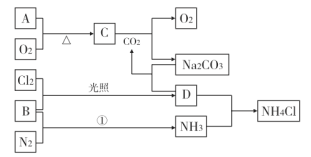
(1)C物质的名称________;①的基本反应类型________________
(2)形成单质B的元素在周期表中位于第________周期第________族。
(3)离子半径A+________O2- (填“<”“>”或“=”)。
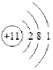
(4)D的电子式________,A的原子结构示意图________
(5)D气体与氨气在空气中相遇发生反应,产生的现象是________________________A单质可以通过电解熔融ACl制取,化学反应方程式:________________________写出足量的D溶液与Na2CO3溶液反应的离子方程式:_______________________________
【答案】过氧化钠 化合反应 一 IA < ![]()
 冒白烟 2NaCl(熔融)
冒白烟 2NaCl(熔融) 2Na+Cl2↑ 2H++CO32-=CO2↑+H2O
2Na+Cl2↑ 2H++CO32-=CO2↑+H2O
【解析】
A为单质且焰色反应为黄色,则A为Na,钠与氧气加热反应生成C为Na2O2;NH3与HCl反应可以生成NH4Cl,所以D为HCl,则B为H2。
(1)C为Na2O2,名称为过氧化钠;反应①为氢气和氮气的化合反应;
(2)B为H2,H元素位于元素周期表第一周期第IA族;
(3)Na+与O2-核外电子层数相同,但O元素原子序数较小,所以离子半径Na+<O2-;
(4)D为HCl,为共价化合物,电子式为![]() ;Na原子结构示意图为
;Na原子结构示意图为 ;
;
(5)HCl气体与氨气在空气中相遇生成氯化铵固体,可观察到有白烟生成;电解熔融NaCl方程式为:2NaCl(熔融) 2Na+Cl2↑;足量HCl溶液与碳酸钠溶液反应生成二氧化碳和水,离子方程式为:2H++CO32-=CO2↑+H2O。
2Na+Cl2↑;足量HCl溶液与碳酸钠溶液反应生成二氧化碳和水,离子方程式为:2H++CO32-=CO2↑+H2O。


科目:高中化学 来源: 题型:
【题目】化学与生产和生活等联系紧密。下列说法正确的是( )
A.“白色污染”泛指聚乙烯、聚丙烯等塑料污染,它们的分子内部都含有双键
B.聚丙烯酸酯类涂料(![]() )是目前流行的墙面涂料之一,它是通过缩聚反应形成的
)是目前流行的墙面涂料之一,它是通过缩聚反应形成的
C.制作手术缝合线或人造器官材料可以是聚乳酸或聚氨酯等
D.制作航天服的聚酯纤维和用于光缆通信的光导纤维都属于新型有机高分子材料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学在环境保护中起着十分重要的作用,电化学降解法可用于治理水中硝酸盐的污染。电化学降解NO3-的原理图所示。下列说法不正确的是:
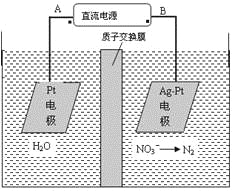
A.A为电源正极
B.阳极反应式为:2H2O-4e-=4H++O2↑
C.若电解过程中转移了2mol电子,则膜两侧电解液的质量变化差(Δm左-Δm右)为10.4克
D.阴极反应式为:2NO3-+6H2O+10e-=N2↑+12OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物G是一种医药中间体,可通过如图所示路线合成。A是石油化工的重要产品且分子中所有原子在同一平面内,H的分子式是C7H8。
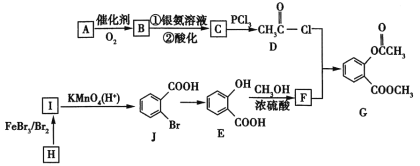
已知:![]() 。
。
回答下列问题。
(1)A的结构简式是___________。
(2)H→I的化学方程式为__________,B与银氨溶液反应的化学方程式是__________。
(3)C→D的反应类型是______,I→J的反应类型是______。
(4)两个E分子在一定条件下发生分子间脱水生成一种环状酯的结构简式是_______________。
(5)满足以下条件的F的同分异构体(不含F)共有_________种。
①能与氯化铁溶液发生显色反应 ②分子中有—COO—结构 ③苯环上有两个取代基
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用图所示实验装置可以完成中学化学实验中的一些实验。
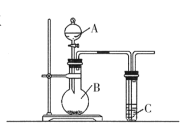
(1)现有稀硝酸、稀盐酸、稀硫酸、碳酸钠粉末、硅酸钠溶液五种试剂。选择三种试剂利用如图装置证明酸性强弱:H2SO4 > H2CO3 > H2SiO3
①仪器B的名称________,A中试剂________,B中试剂________
②C中发生反应的化学方程式:________________________________
(2)利用如图装置实验,证明二氧化硫气体具有漂白性。已知:Na2SO3 + H2SO4=Na2SO4 +SO2↑+H2O。 在装置A中加入 70%的硫酸溶液,B中加入Na2SO3粉末,
①C中应加入________溶液(填“品红”或“石蕊”)。打开分液漏斗活塞,一段时间后观察到C中现象是________________________________,反应完全后,将C试管加热一 段时间发生的现象是________________________
②如果仅用如图装置进行此实验,可能造成环境污染,此污染属于________(选填“白色污染”或“酸雨污染"),因此应该在C装置后加一个盛有________溶液的洗气瓶。
③将二氧化硫气体通入FeCl3溶液中反应一.段时间后,滴加KSCN溶液,溶液未变红色,请写出所发生反应的离子方程式:________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.现有下列仪器或用品:①铁架台(含铁圈、各式铁夹) ②锥形瓶 ③酸式滴定管和碱式滴定管 ④烧杯 ⑤玻璃棒 ⑥胶头滴管 ⑦天平(含砝码) ⑧滤纸 ⑨量筒 ⑩过滤漏斗;
现有下列药品:(A)NaOH固体 (B)标准NaOH溶液(C)未知浓度盐酸 (D)蒸馏水(E)碳酸钠溶液
根据所做过的学生实验,回答下列问题:
(1)过滤时,应选用的上述仪器是_________________________(填编号)。
(2)配制一定物质的量浓度的NaOH溶液时,还缺少的仪器是__________。
(3)做酸碱中和滴定时,还缺乏的试剂是____________________。
(4)进行中和滴定时,绝不可用将要盛的溶液事先润洗的仪器是下列的______(填编号)。甲.酸式滴定管 乙.碱式滴定管 丙.锥形瓶
(5)用标准的NaOH溶液滴定未知浓度的盐酸,选用酚酞作为指示剂,造成测定结果偏高的原因可能是______________。
A.配制标准溶液的NaOH中混有Na2CO3杂质
B.滴定终点读数时,俯视滴定管的刻度,其他操作正确
C.盛装未知液的锥形瓶用蒸馏水洗过,未用未知液润洗
D.滴定前有气泡,滴定后气泡消失。
II. 甲醇(CH3OH)是一种可再生能源,具有广泛的开发和应用前景。
(1)工业上一般采用下列两种反应合成甲醇:
反应I:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH1
CH3OH(g)+H2O(g) ΔH1
反应II:CO(g)+2H2(g)![]() CH3OH(g) ΔH2
CH3OH(g) ΔH2
①反应I的平衡常数表达式为K=________________________
②下表所列数据是反应Ⅱ在不同温度下的化学平衡常数(K)
温度 | 250℃ | 300℃ | 350℃ |
K | 2.041 | 0.270 | 0.012 |
由表中数据判断ΔH2______0,ΔS______0 (填“>”、“=”或“<”=)。
③某温度下,将2 mol CO和6 mol H2充入2L的密闭容器中,充分反应,达到平衡后,测得c(CO)=0.2 mol·L-1,则CO的转化率为________。
(2)已知在常温常压下,某实验小组依据甲醇燃烧的反应原理,设计如下图所示的电池装置:

①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g) ΔH =-1275.6 kJ·mol-1
②H2O(g)=H2O(l) ΔH =-44.0 kJ·mol-1
①写出表示甲醇燃烧热的热化学方程式____________________。
②写出上图电池装置中负极反应式:________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】法医常用马氏试砷法检验是否砒霜( As2O3)中毒,涉及的反应如下:
I:6Zn+As2O3+12HCl=6ZnCl2+2AsH3(砷烷)↑+3H2O
Ⅱ:2AsH3=2As(黑色砷镜)+3H2
(1)写出砷的基态原子价电子排布图______________。
(2)砷烷的空间结构为_______;砷烷中心原子杂化方式为________。
(3)砷烷同族同系列物质相关性质如下表:
NH3 | PH3 | AsH3 | SbH3 | |
熔点/℃ | -77.8 | -133.5 | -116.3 | -88 |
沸点/℃ | -34.5 | -87.5 | -62.4 | -18.4 |
从PH3→AsH3→SbH3熔沸点依次升高的原因是_________;NH3分子例外的原因是_______。
(4)第一电离能数据I(As)>I(Se),可能的原因是_____________。
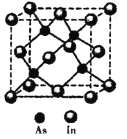
(5)砷与铟(In)形成的化合物(X)具有优良的光电性能,广泛应用于光纤通信用激光器,其晶胞结构如图所示,则其化学式为______;晶胞边长a= 666.67pm,则其密度为_____g/cm3(边长a可用![]() 近似计算,设NA=6.0×1023/mol)。
近似计算,设NA=6.0×1023/mol)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图象中,纵坐标为沉淀物的量,横坐标为溶液中加入反应物的物质的量,试按题意将图象中相应的数字序号填入表中的顺序为
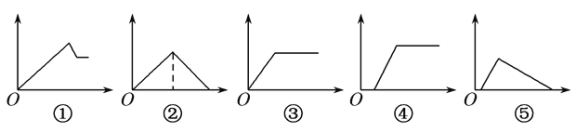
溶液 | 加入物质 | 相应序号 |
(1)氯化铝溶液 | 加入过量氨水 | |
(2)饱和澄清石灰水 | 通入过量CO2气体 | |
(3)含少量NaOH的偏铝酸钠溶液 | 通入过量CO2气体 | |
(4)含少量NaOH的偏铝酸钠溶液 | 逐滴加入稀盐酸 | |
(5)MgCl2、AlCl3的混合溶液 | 逐滴加入NaOH溶液至过量 |
A. ①③②④⑤ B. ③⑤④②①
C. ①②③④⑤ D. ③②④⑤①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人体血液中存在的平衡:H2CO3 ![]() HCO3-,使血液pH保持在7.35 ~ 7.45之间,否则就会发生酸中毒或碱中毒。已知pH随
HCO3-,使血液pH保持在7.35 ~ 7.45之间,否则就会发生酸中毒或碱中毒。已知pH随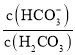 变化关系如表所示,则下列说法中错误的是
变化关系如表所示,则下列说法中错误的是
| 1.0 | 17.8 | 20.0 | 22.4 |
pH | 6.10 | 7.35 | 7.40 | 7.45 |
A.pH=7的血液中,c(HCO3-)>c(H2CO3)
B.正常体温下人体发生碱中毒时,c(H+)c(OH-)变大
C.人体发生酸中毒时,可静脉滴注一定浓度的NaHCO3溶液解毒
D.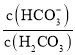 =20.0时,H2CO3的电离程度小于HCO3-的水解程度
=20.0时,H2CO3的电离程度小于HCO3-的水解程度
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com