
【题目】H2O分子中每个O原子结合2个H原子的根本原因是
A. 共价键的方向性 B. 共价键的键长
C. 共价键的键角 D. 共价键的饱和性
 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案科目:高中化学 来源: 题型:
【题目】磺化钠在医药中用作甲状腺肿瘤防治剂、袪痰剂和利尿剂,也用作食品添加剂、感光剂等。工业上用水合肼(N2H4·H2O)还原法制取碘化钠固体,其制备流程如图所示:
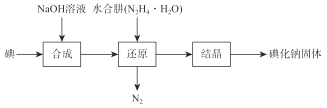
己知:N2H4·H2O在100℃以上分解。
(1)在合成NaI的过程中,可能混有的物质是_______,生产过程中要适当补充NaOH,目的是________。
(2)在还原过程中,为了防止水合肼(N2H4·H2O)高温分解,反应温度控制在60~70℃,温度也不能过低,其原因是___________。工业上也可以用硫化钠或铁屑还原碘酸钠制备碘化钠,但水合肼还原法制得的产品纯度更高,其原因是_____________________。
(3)请设计一个简单的实验来检验还原液中是否含有IO3-:__________________。(可供选择的试剂:稀硫酸、淀粉溶液、FeCl3溶液)
(4)测定产品中NaI含量的实验步骤如下:
a.称取4.000 g样品并溶解,在250 mL容量瓶中定容;
b.量取25.00 mL待测液于锥形瓶中,然后加入足量的FeCl3溶液,充分反应后,再加入A溶液作指示剂;
c.用0.1000mol·L-1的Na2S2O3溶液滴定至终点(发生反应方程式为:2Na2S2O3+I2=Na2S4O6+2NaI),重复测定3次,所得的相关数据如表所示:
测定序号 | 待测体积/ml | 盛装标准滴定管的起点读数/ml | 盛装标准滴定管的终点读数/ml |
1 | 25.00 | 0.06 | 24.04 |
2 | 25.00 | 0.02 | 24.02 |
3 | 25.00 | 0.12 | 24.14 |
①在滴定过程中,Na2S2O3溶液应放___________(填仪器)中;加入的A物质为____________(填名称)。
②滴定终点观察到的现象为_______________________。
③该样品中NaI的含量为_______________________。
④若用上述方法测得NaI的含量偏低(忽略测定过程中的误差),则可能的原因是_________________。
(5)碘化钠固体的保存方法是_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A. 由极性键结合而成的分子一定是极性分子
B. 非极性键只存在于双原子单质分子里
C. 非极性分子中,一定含有非极性键
D. 一般情况下,极性分子易溶于极性溶剂,非极性分子易溶于非极性溶剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】石棉尾矿主要含有 Mg3(Si2O5)(OH)4 和少量的 Fe2O3、Al2O3。以石棉尾矿为镁源制备碳酸镁晶须(MgCO3nH2O)的工艺如下:

已知“焙烧”过程中的主反应为:Mg3(Si2O5)(OH)4+5(NH4)2SO4![]() 3MgSO4+10NH3↑+2SiO2+7H2O↑+2SO3↑。
3MgSO4+10NH3↑+2SiO2+7H2O↑+2SO3↑。
(1)写出焙烧产物 NH3 的电子式___________。
(2)为提高水浸速率,可采取的措施为________________(任写一条)。“浸渣”的主要成分为_________________。
(3)“除铁、铝”时,需将 pH 调至 8.0 左右,适宜作调节剂的是____(填字母代号)。
a.NaOH b.Mg(OH)2 c.NH3H2O
(4)“沉镁”过程中反应的离子方程式为______________。“沉镁”时若温度超过 60℃,将产生较多的碱式碳酸镁杂质,原因是_______。
(5)流程中可以循环利用的物质是______(填化学式)。

(6)某小组同学称取 13.8 g MgCO3nH2O 进行热重分析,并绘制剩余固体质量随温度变化的曲线如图所示,则 n=________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化氯(ClO2)是极易溶于水且不与水发生化学反应的黄绿色气体,沸点为 11℃,可用于处理含硫废水。某小组在实验室中探究 ClO2 与 Na2S 的反应。回答下列问题:
(1)ClO2 的制备
已知:SO2+2NaClO3+H2SO4=2ClO2↑+2NaHSO4
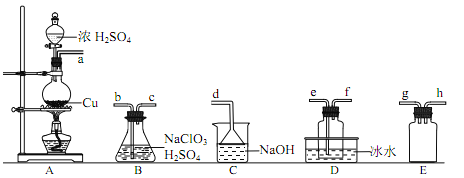
①装置 A 中反应的化学方程式为____________。
②欲收集干燥的 ClO2,选择上图中的装置,其连接顺序为 a→________________(按气流方向,用小写字母表示)
③装置 D 的作用是__________________。
(2)ClO2 与 Na2S 的反应
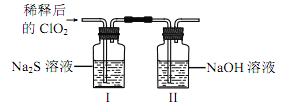
将上述收集到的 ClO2 用 N2 稀释以增强其稳定性,并将适量的稀释后的 ClO2 通入上图所示装置中充分反应,得到无色澄清溶液。一段时间后,通过下列实验探究 I 中反应的产物。
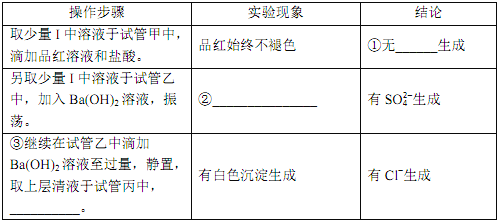
①___________。②___________。③___________。
④ClO2 与 Na2S 反应的离子方程式为____________。用于处理含硫废水时,ClO2 相对于Cl2 的优点是____________(任写一条)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com