
下列化学反应的离子方程式正确的是( )
A.氢氧化钡溶液与稀硫酸的反应:OH﹣+H+=H2O
B.澄清的石灰水与稀醋酸反应:Ca(OH)2+2H+=Ca2++2H2O
C.在Ca(HCO3)2溶液中加入过量氢氧化钠溶液:Ca2++HCO3﹣+OH﹣=CaCO3↓+H2O
D.往澄清石灰水通入过量二氧化碳气体:CO2+OH﹣=HCO3﹣
考点:离子方程式的书写.
分析:A.二者反应生成硫酸钡和水,漏掉了生成生成硫酸钡的反应;
B.醋酸为弱酸,离子方程式中醋酸不能拆开,澄清石灰水中的氢氧化钙应该拆开;
C.氢氧化钠过量,反应后碳酸根离子有剩余;
D.二氧化碳过量,反应生成碳酸氢钙.
解答: 解:A.氢氧化钡溶液与稀硫酸的反应生成硫酸钡和水,正确的离子方程式为:2H++SO42﹣+Ba2++2OH﹣=BaSO4↓+2H2O,故A错误;
B.澄清石灰水与稀醋酸反应生成醋酸钙和水,正确的离子方程式为:OH﹣+CH3COOH=H2O+CH3COO﹣,故B错误;
C.在Ca(HCO3)2溶液中加入过量氢氧化钠溶液,反应生成碳酸钙沉淀、碳酸钠和水,正确的离子方程式为:Ca2++2HCO3﹣+2OH﹣=CaCO3↓+2H2O+CO32﹣,故C错误;
D.澄清石灰水通入过量二氧化碳气体,反应生成碳酸氢钙,反应的离子方程式为:CO2+OH﹣=HCO3﹣,故D正确;
故选D.
点评:本题考查了离子方程式的判断,为中等难度的试题,注意掌握离子方程式的书写原则,明确离子方程式正误判断常用方法:检查反应能否发生,检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合原化学方程式等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
下列关于热化学反应的描述中正确的是( )
A.HCl和NaOH反应的中和热ΔH=-57.3 kJ/mol,则H2SO4和Ca(OH)2反应的中和热ΔH=2×(-57.3)kJ/mol
B.碳与二氧化碳反应既是吸热反应,又是化合反应
C.热化学方程式中化学计量系数可表示分子个数
D.1 mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热
查看答案和解析>>
科目:高中化学 来源: 题型:
)某班学生分成甲,乙两小组分别探究硫,氮及其化合物的性质:
(一)甲组同学用图1装置来探究浓硫酸与木炭粉加热反应并验证反应所产生的各种产物.
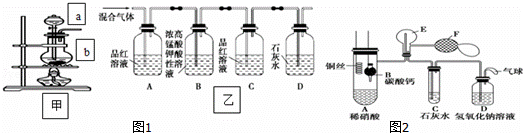
(1)装置甲中盛放浓硫酸的仪器a名称是 ,装置甲中仪器b中发生反应的化学方程式为
(2)实验中可观察到装置乙中,A瓶的溶液褪色,C瓶的溶液不褪色.
A瓶溶液的作用是 ,
D瓶溶液的现象是 .
(二)乙组同学用图2装置来证明铜与稀硝酸反应产生一氧化氮,B为一个用金属丝固定的干燥管,内装块状碳酸钙固体;E为一个空的蒸馏烧瓶;F是用于鼓入空气的双连打气球.(1)实验时,先将B装置下移,使碳酸钙与稀硝酸接触产生气体,当C处产生白色沉淀时,立刻将B装置上提,使之与稀硝酸分离.该组学生设计此步操作的目的是 .
(2)装置E中开始时出现浅红棕色气体,用F向E中鼓入空气后,可观察到烧瓶E内气体颜色加深,产生上述现象的原因是 .
(3)一段时间后,C中白色沉淀溶解,其原因是
(4)装置D的作用是
查看答案和解析>>
科目:高中化学 来源: 题型:
硫元素有多种化合价,可形成多种化合物.
(1)常温下用1mol•L﹣1200mLNaOH溶液恰好完全吸收0.1molSO2气体,此反应的离子方程式为 ,请用离子方程式表示该溶液PH>7的原因 H ,该溶液放置于空气中一段时间后,溶液的PH (填“增大”“减小”或“不变”)
(2)SO2能使酸性高锰酸钾溶液褪色,该反应的离子方程式为 ,实验室通常选择 (选填“稀盐酸”、“稀硫酸”)对高锰酸钾溶液进行酸化.
(3)课本中选用Na2S2O3与稀硫酸的反应来研究物质的温度对化学反应速率的影响.选用Na2S2O3来比较化学反应速率快慢的原因是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
溶液、胶体和浊液这三种分散系的根本区别是( )
A.是否是大量分子或离子的集合体
B.分散质粒子的大小
C.是否能通过滤纸
D.是否均一、透明、稳定
查看答案和解析>>
科目:高中化学 来源: 题型:
一般情况下胶体稳定,胶体微粒不易聚集,主要原因是( )
A.胶体有丁达尔现象
B.胶体有布朗运动
C.胶体微粒因吸附带电荷离子而带电,带同种电荷的微粒间相互排斥
D.胶体微粒直径在1~100nm之间,微粒小,不受重力作用
查看答案和解析>>
科目:高中化学 来源: 题型:
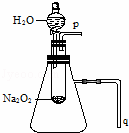
实验:用脱脂棉包住约0.2g过氧化钠粉末,置于石棉网上,往脱脂棉上滴水,观察到脱脂棉剧烈燃烧起来.
(1)由上述实验现象所得出的有关过氧化钠跟水反应的结论是:
第一,有氧气生成,第二, .Na2O2跟水反应的化学方程式是 .
(2)某研究性学习小组拟用A图所示装置(气密性良好)进行实验,以证明上述结论.用以验证第一条结论的实验方法是: ;用以验证第二条结论的实验方法是: .
查看答案和解析>>
科目:高中化学 来源: 题型:
用NA表示阿伏加德罗常数的值,则下列叙述正确的是( )
|
| A. | 常温下,4.48L N2和O2的混合气体中所含原子数为0.4NA |
|
| B. | 常温下,1.0L1.0mol•L﹣1 NaAlO2溶液中含有的氧原子数为2NA |
|
| C. | 7.8g Na2S和Na2O2的混合物中含有的阴离子数等于0.1NA |
|
| D. | 0.1mol Fe参加氧化还原反应,转移的电子数目一定是0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA表示阿伏加德罗常数,下列说法正确的是()
A. 1 mol氯气参加氧化还原反应,转移的电子数一定为2NA
B. 常温常压下,由6 g NO2和40 g N2O4组成的混合气体中原子总数为3NA
C. 0.1 mol•L﹣1 NaF溶液中,HF和F﹣总和为0.1NA个
D. 12.5 mL 16 mol•L﹣1浓硫酸与足量铜反应,生成SO2的分子数为0.1NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com