
【题目】下表为元素周期表的一部分,请参照元素①-⑧在表中的位置,回答下列问题:
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
1 | ① | |||||||
2 | ② | ③ | ④ | |||||
3 | ⑤ | ⑥ | ⑦ | ⑧ |
(1)③、④、⑤的原子半径由大到小的顺序为___(用元素符号回答)。
(2)②、③、⑦的最高价氧化物对应的水化物酸性由强到弱的顺序是___。(用化学式回答)
(3)②、⑧两种元素形成的某化合物是一种常见的有机溶剂,写出该化合物的电子式___。
(5)⑦的最简单氢化物是一种无色气体,遇到空气能发生爆炸性自燃。已知室温下1g该氢化物自燃放出45.0kJ的热量(产物为⑦的氧化物和液态水),其热化学方程式为___。
【答案】Na>N>O HNO3>H2CO3>H2SiO3  2Al+2OH-+2OH-=2
2Al+2OH-+2OH-=2![]() +3H2↑ SiH4(g)+2O2(g)=SiO2(s)+2H2O(l) △H=-1440.0kJ·mol-1
+3H2↑ SiH4(g)+2O2(g)=SiO2(s)+2H2O(l) △H=-1440.0kJ·mol-1
【解析】
根据元素周期表,推出①为H,②为C,③为N,④为O,⑤为Na,⑥为Al,⑦为Si,⑧为Cl,据此分析;
(1)③为N,④为O,⑤为Na,同周期从左向右原子半径依次减小,同主族从上到下,原子半径依次增大,因此原子半径由大到小的顺序是Na>N>O;
(2)②为C,③为N,⑦为Si,非金属性越强,其最高价氧化物对应水化物的酸性越强,同主族从上到下,非金属性减弱,同周期从左向右非金属性增强,因此最高价氧化物对应的水化物的酸性由强到弱的顺序是HNO3>H2CO3>H2SiO3;
(3)②为C,⑧为Cl,两种元素形成的某化合物是一种常见的有机溶剂,即为CCl4,CCl4属于共价化合物,其电子式为 ;
;
(4)⑥为Al,与NaOH溶液反应的离子方程式为2Al+2OH-+2OH-=2![]() +3H2↑;
+3H2↑;
(5)⑦为Si,其最简单的氢化物为SiH4,与氧气反应的方程式为SiH4+2O2=SiO2+2H2O,1gSiH4的物质的量为![]() =
=![]() mol,1molSiH4燃烧放出的热量为45.0kJ×32=1440.0kJ,则热化学反应方程式为SiH4(g)+2O2(g)=SiO2(s)+2H2O(l) △H=-1440.0kJ·mol-1。
mol,1molSiH4燃烧放出的热量为45.0kJ×32=1440.0kJ,则热化学反应方程式为SiH4(g)+2O2(g)=SiO2(s)+2H2O(l) △H=-1440.0kJ·mol-1。


科目:高中化学 来源: 题型:
【题目】乙醇做为可再生能源比化石能源具有较大的优势,如图为乙醇燃料电池,该电池的总反应方程式为C2H5OH+3O2=2CO2+3H2O。下列关于该电池叙述错误的是

A.a极与用电器的正极相接B.该装置将化学能转化为电能
C.质子(H+)由装置左侧向右侧移动D.该装置的电解质溶液呈酸性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近期发现,H2S是继NO、CO之后的第三个生命体系气体信号分子,它具有参与调节神经信号传递、舒张血管减轻高血压的功能。回答下列问题:
(1)如图是通过热化学循环在较低温度下由水或硫化氢分解制备氢气的反应系统原理。

通过计算,可知系统(Ⅰ)和系统(Ⅱ)制氢的热化学方程式分别为__、__,制得等量H2所需能量较少的是__。
(2)H2S与CO2在高温下发生反应:H2S(g)+CO2(g)![]() COS(g)+H2O(g)。在610K时,将0.10molCO2与0.40molH2S充入2.5L的空钢瓶中,反应平衡后水的物质的量分数为0.02。
COS(g)+H2O(g)。在610K时,将0.10molCO2与0.40molH2S充入2.5L的空钢瓶中,反应平衡后水的物质的量分数为0.02。
①H2S的平衡转化率α1=__%,反应平衡常数K=__。
②在620K重复试验,平衡后水的物质的量分数为0.03,H2S的转化率α2__α1,该反应的ΔH__0。(填“>”“<”或“=”)
③向反应器中再分别充入下列气体,能使H2S转化率增大的是__(填标号)
A.H2S B.CO2 C.COS D.N2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车发动机稀燃控制系统主要工作原理是发动机在稀燃和富燃条件下交替进行,尾气中的NOx在催化剂上反应脱除。其工作原理示意图如下:

下列说法不正确的是
A. 稀燃过程中,NO发生的主要反应为:2NO + O2 === 2NO2
B. 稀燃过程中,NO2被吸收的反应为:BaO + 2NO2 === Ba(NO3)2
C. 富燃过程中,NO2被CO还原的反应为:2NO2 + 4CO === N2 + 4CO2
D. 富燃过程中,CxHy被O2氧化的反应为:CxHy + (x+y/4)O2 == xCO2 + y/2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科学家成功实现甲烷在催化剂及无氧条件下,一步高效生产乙烯、芳香烃和氢气等化产品,为天然气化工开发了一条革命性技术。以甲烷为原料合成部分化工产品流程如图(部分反应条件已略去):

(1)E中官能团的名称为___,C物质的结构简式为___。
(2)上述③~⑥转化反应中,属于取代反应的有___(用反应序号填写)。
(3)写出反应⑦的反应方程式:__。
(4)实验室制备物质E时,装置如图所示(加热和夹持装置已省略)。试管a中实验前盛放的物质是___,实验后出现分层现象,分离物质D需要的玻璃仪器有___和烧杯等。

(5)某同学在试管b中加入6.0克乙酸和足量乙醇采用适当条件使反应充分进行,结束后在试管b回收到3.0克乙酸,则该同学在本次实验中制得乙酸乙酯的最大质量为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应3X(g)+Y(g)2Z(g)+2W(g)在 2L密闭容器中进行,10 min后 Y减少了1.0 mol,则此反应的平均速率v为
A.v(X)=0.05mol·L-1·min-1B.v(Z)=0.10mol·L-1·min-1
C.v(Y)=0.10mol·L-1·min-1D.v(W)=0.05mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知铁离子,氯气、溴均为常见的氧化剂,某化学兴趣小组设计了如下实验探究其强弱:
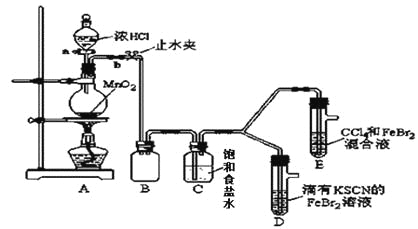
(1)①装置A中发生反应的离子方程式是_________________。
②整套实验装置存在一处明显的不足,请指出________。
(2)用改正后的装置进行实验,实验过程如下:
实验操作 | 实验现象 | 结论 |
打开活塞a,向圆底烧瓶中滴入适量浓盐酸;然后_______________。(填具体实验操作) | D装置中:溶液变红 E装置中:水层溶液变黄, 振荡后,下层CCl4层无明显变化。一段时间后______。(填实验现象) | Cl2、Br2、Fe3+的氧化性由强到弱的顺序为:Cl2>Br2>Fe3+ |
(3)因忙于观察和记录,没有及时停止反应,D、E中均发生了新的变化。
D装置中:红色慢慢褪去。
E装置中:CCl4层颜色逐渐加深,直至变成红色。
为探究上述实验现象的本质,小组同学查得资料如下:
ⅰ.Fe3+ +3SCN-![]() Fe(SCN)3是一个可逆反应。
Fe(SCN)3是一个可逆反应。
ⅱ.(SCN)2性质与卤素单质类似。氧化性:Cl2 > (SCN)2。
①请用平衡移动原理(结合上述资料)解释Cl2过量时D中溶液红色褪去的原因____。现设计简单实验证明上述解释:取少量褪色后的溶液,滴加________溶液,若溶液颜色______________。则上述解释是合理的。
小组同学另查得资料如下:
ⅲ.Cl2和Br2反应生成BrCl,BrCl呈红色(略带黄色),沸点约5℃,它与水能发生水解反应,且该反应为非氧化还原反应。
ⅳ.AgClO、AgBrO均可溶于水。
②欲探究E中颜色变化的原因,设计实验如下:
用分液漏斗分离出E的下层溶液,蒸馏、收集红色物质,取少量,加入AgNO3溶液,结果观察到仅有白色沉淀产生。请结合上述资料用两步离子方程式解释仅产生白色沉淀原因___________、___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢气和氯气混合光照即可发生爆炸而释放出大量的热量。在反应过程中,断裂1 mol H2中的化学键消耗的能量为Q1 kJ,断裂1 molCl2中的化学键消耗的能量为Q2 kJ,形成1 mol HCl中的化学键释放的能量为Q3 kJ。下列关系式中正确的是
A.Q1+ Q2<2Q3B.Q1+ Q2>2Q3C.Q1+ Q2<Q3D.Q1+ Q2>Q3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】己烯雌酚是一种激素类药物,结构如下.下列有关叙述中不正确的是( )

A. 它易溶于有机溶剂
B. 可与NaOH和NaHCO3发生反应
C. 1mol该有机物可以与5molBr2发生反应
D. 该有机物分子中,可能有16个碳原子共平面
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com