
肼是重要的化工原料。某探究小组利用下
列反应制取水合肼(N2H4·H2O)。
CO(NH2)2+ 2NaOH + NaClO = Na2CO3 + N2H4·H2O + NaCl
实验一: 制备NaClO溶液。(实验装置如右图所示)
(1)配制30%NaOH溶液时,所需玻璃仪器除量筒外还有 (填标号)。
A.容量瓶 B.烧杯 C.烧瓶 D.玻璃棒
(2) 锥形瓶中发生反应的化学方程式是 。

(3) 因后续实验需要,需利用中和滴定原理测定反应后锥形瓶中混合溶液的NaOH的浓
度。请选用所提供的试剂(H2O2溶液、FeCl2溶液、0.1000mol·L-1盐酸、酚酞试液),设计实验方案。
。
实验二: 制取水合肼。(实验装置如右图所示)

控制反应温度,将分液漏斗中溶液缓慢滴入三颈烧瓶中,充分反应。
加热蒸馏三颈烧瓶内的溶液,收集108~114℃馏分。(已知:N2H4·H2O + 2NaClO = N2↑ + 3H2O + 2NaCl)
(4)分液漏斗中的溶液是 (填标号)。
A.CO (NH2) 2溶液 B.NaOH和NaClO混合溶液
选择的理由是 。
实验三: 测定馏分中肼含量。
称取馏分5.000g,加入适量NaHCO3固体,加水配成250mL溶液,移出25.00mL,用0.1000mol·L-1的I2溶液滴定。滴定过程中,溶液的pH保持在6.5左右。(已知:N2H4·H2O + 2I2 = N2↑+ 4HI + H2O)
(5)滴定过程中,NaHCO3能控制溶液的pH在6.5左右,原因是 。
(6)实验测得消耗I2溶液的平均值为18.00mL,馏分中水合肼(N2H4·H2O)的质量分数为 。
【知识点】有化学实验方案设计与评价
【答案解析】 (1) B、D (2) Cl2+ 2NaOH = NaClO + NaCl + H2O
(3) 取一定量锥形瓶内混合溶液,加入适量的H2O2溶液后,滴加2~3滴酚酞试液,用 0.100mol·L-1盐酸滴定,重复上述操作2~3次
(4) B 如果次氯酸钠溶液装在烧瓶中,反应生成的水合肼会被次氯酸钠氧化
(5) NaHCO3会与滴定过程中产生的HI反应 (6) 9%
解析:(1)配制溶液需要在烧杯内进行,需要用量筒量取水,用玻璃棒搅拌,还用到胶头滴管,所以选择BD;(2)Cl2与NaOH溶液发生反应时,生成氯化钠、次氯酸钠和水。所以反应物是氯气和氢氧化钠,生成物是氯化钠、次氯酸钠和水,用观察法配平即可,所以方程式是:Cl2+2NaOH=NaCl+NaClO+H2O;(3)取一定量锥形瓶内混合溶液,加入适量的H2O2溶液后(加双氧水的目的是除去溶液中的次氯酸跟离子),滴加2~3滴酚酞试液,用 0.100mol·L-1盐酸滴定,重复上述操作2~3次 。(4)分液漏斗中的溶液是NaOH和NaClO混合溶液,因为如果次氯酸钠溶液装在烧瓶中,反应生成的水合肼会被次氯酸钠氧化。(5)NaHCO3会与滴定过程中产生的HI反应,所以可以控制溶液的pH值。(6)根据方程式I2 的物质的量是0.1x18x10-3=1.8x10-3mol,水合肼的物质的量是0.9x10-3mol,其质量为0.045g因为只取用了原溶液的十分之一,所以质量分数为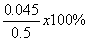 =9%
=9%
【思路点拨】本题考查实验方案的设计与评价,比如实验仪器的选择,滴定实验中的除杂,还有题,考查学生综合分析问题的能力、提取信息的能力等方面,难度中等。


 智能训练练测考系列答案
智能训练练测考系列答案科目:高中化学 来源: 题型:
某实验小组用工业上废弃固体(主要成分Cu2S和Fe2O3)混合物制取粗铜和Fe2(SO4)3晶体,设计的操作流程如下:
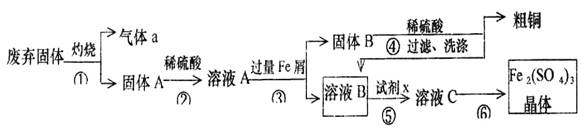
(1)除酒精灯和铁架台或三脚架外,①中所需的容器名称为 ;
(2)已知试剂x为过氧化氢,写出H2O2与溶液B反应的离子方程式为 ;
(3)写出步骤③发生反应的离子方程式 ;
(4)步骤⑥的实验操作为 、过滤、烘干。
(5)某同学取少量的溶液B向其中加入过量的某种强氧化剂,再滴加KSCN溶液,发现溶液变红色,放置一段时间后,溶液褪色,该同学猜测溶液褪色的原因是溶液中的
SCN—被过量的氧化剂氧化所致。
现给出以下试剂:1.0 mol/L硫酸、1.0 mol/LNaOH溶液、0.1 mol/LFe2(SO4)3溶液、20%KSCN溶液、蒸馏水。请你设计合趣实验验证乙同学的猜测是否合理。简要说明实验步骤和现象
。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是
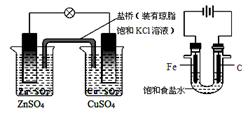
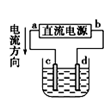
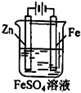
① ② ③ ④
A.图①铜锌原电池工作时,盐桥中的K+移向ZnSO4溶液
B.图②装置反应一段时间,将湿润的KI淀粉试纸靠近碳电极管口,试纸变蓝
C.用装置③精炼铜,则d极为粗铜,c极为纯铜,电解质溶液为CuSO4溶液
D.用装置④可进行铁片镀锌
查看答案和解析>>
科目:高中化学 来源: 题型:
从带中提取碘的实验过程中(萃取剂用苯),涉及到下列操作,
其中正确的是


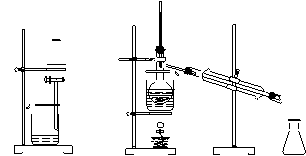

A.将海带灼 B.过滤得含 C.放出碘的 D.分离碘并回收苯
烧成灰 I-溶液 苯溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
氨基甲酸铵(NH2COONH4)是一种白色固体,易分解、易水解,可用做肥料、灭火剂、洗涤剂等。某化学兴趣小组模拟工业原理制备氨基甲酸铵,
反应的化学方程式如下:
2NH3(g)+CO2(g)  NH2COONH4(s) ΔH<0
NH2COONH4(s) ΔH<0
(1)如用右图装置制取氨气,你所选择的试剂是 。

(2)制备氨基甲酸铵的装置如下图所示,把氨气和二氧化碳通入四氯化碳中,不断搅拌混合,生成的氨基甲酸铵小晶体悬浮在四氯化碳中。当悬浮物较多时,停止制备。
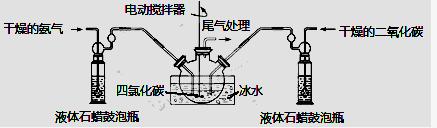
注:四氯化碳与液体石蜡均为惰性介质。
①发生器用冰水冷却的原因是: 、 。液体石蜡鼓泡瓶的作用是: 。
②从反应后的混合物中分离出产品,为了得到干燥产品,应采取的方法是_______ (填写选项序号)。
a.常压加热烘干 b.高压加热烘干 c.真空40 ℃以下烘干
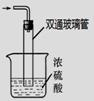
③尾气处理装置如右图所示。双通玻璃管的作用: ;
浓硫酸的作用: 、 。
(3)取因部分变质而混有碳酸氢铵的氨基甲酸铵样品11.73 g,用足量石灰水 充分处理后,使碳元素完全转化为碳酸钙,过滤、洗涤、干燥,测得质量为15.00 g。则样品中氨基甲酸铵的物质的量分数为 。
[Mr(NH2COONH4)=78g/mol、Mr(NH4HCO3) =79 g/mol、Mr(CaCO3)=100 g/mol]【来.源:全,
查看答案和解析>>
科目:高中化学 来源: 题型:
某化工厂设计要求为:空气中二氧化硫含量不得超过0.02 mg·L-1。
某同学拟用下图所示简易装置测定空气中的SO2含量:准确移取10mL 5×10-4 mol·L-1的标准碘水溶液,注入试管中,加2~3滴淀粉指示剂,此时溶液呈蓝色。在指定的测定地点抽气,每次抽气100mL,直到溶液的蓝色全部褪尽为止。假设该同学的测量是准确的,则他抽气的次数至少为 次时方可说明该厂空气中的SO2含量达标。
查看答案和解析>>
科目:高中化学 来源: 题型:
化学上有许多方法可以用于
鉴别食盐和“工业盐”,下列方法可行的是:
①加入稀硫酸,微热,看能否产生红棕色气体。②加入酸化的碘化钾淀粉溶液,看溶液是否变蓝。③加入酸化的氯化亚铁溶液,看溶液是否变成棕黄色。④加入酸性高锰酸钾溶液,看能否褪色。⑤加入硝酸酸化的硝酸银溶液,看能否产生白色沉淀。
A.只有①②③④ B.只有②③④⑤ C.只有③④⑤ D.①②③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
下列结论均出自《实验化学》中的实验,其中不正确的是
A.硫酸铜溶液中加入过量浓氨水,可得到深蓝色透明溶液
B.NaCl溶液热发结晶时,蒸发皿中有晶体析出并剩余少量液体即停止加热
C.实验室从海带中提取单质碘的方法是:取样→灼烧→溶解→过滤→氧化→萃取
D.用纸层析法分离Cu2+和Fe3+,滤纸上端呈棕黄色,说明Fe3+在固定相中分配的更多
查看答案和解析>>
科目:高中化学 来源: 题型:
对于恒容密闭容器中发生的可逆反应N2(g)+3H2(g)2NH3(g) ΔH<0,能说明反应达到化学平衡状态的是( )
A.断开1个N≡N键的同时有6个N—H键生成
B.混合气体的密度不变
C.混合气体的平均相对分子质量不变
D.N2、H2、NH3分子数之比为1:3:2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com