
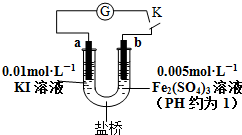
| A. | 电流计G指针指向零时,说明U形管中反应达到平衡状态 | |
| B. | 当电路中电流为零时,增加KI溶液的浓度,则a极为正极 | |
| C. | 当U形管b端颜色逐渐加深时,说明b极为负极 | |
| D. | 盐桥中阳离子一定向右移动 |
分析 常温下能自发进行的放热的氧化还原反应都可设计成原电池,根据总反应2Fe3++2I-?2Fe2++I2可知,Fe元素化合价降低,I元素化合价升高,负极上失电子、正极上得电子,所以a负极、b为正极,
A.当电流计为零时,说明没有电子发生转移,则该反应正逆反应速率相等;
B.当电路中电流为零时,增加KI溶液的浓度,平衡正向移动,发生的反应为2Fe3++2I-?2Fe2++I2,a仍然是负极;
C.当U形管b端颜色逐渐加深时,说明平衡逆向移动,发生的反应为2Fe2++I2?2Fe3++2I-,则b上失电子、a上得电子;
D.盐桥中阳离子向正极区域移动.
解答 解:常温下能自发进行的放热的氧化还原反应都可设计成原电池,根据总反应2Fe3++2I-?2Fe2++I2可知,Fe元素化合价降低,I元素化合价升高,负极上失电子、正极上得电子,所以a负极、b为正极,
A.当电流计为零时,说明没有电子发生转移,则该反应正逆反应速率相等,反应达到平衡状态,故A正确;
B.当电路中电流为零时,增加KI溶液的浓度,平衡正向移动,发生的反应为2Fe3++2I-?2Fe2++I2,a上仍然失电子发生氧化反应,所以a仍然是负极,故B错误;
C.当U形管b端颜色逐渐加深时,说明平衡逆向移动,发生的反应为2Fe2++I2?2Fe3++2I-,则b上失电子、a上得电子,则a是正极、b是负极,故C正确;
D.盐桥中阳离子向正极区域移动,如果发生的反应为2Fe3++2I-?2Fe2++I2,则盐桥中阳离子向b移动,如果发生的反应为2Fe2++I2?2Fe3++2I-,则盐桥中阳离子向a移动,故D错误;
故选AC.
点评 本题考查原电池原理和化学平衡移动,为高频考点,明确各个电极上发生的反应及平衡移动影响因素是解本题关键,注意正负极的判断方法,题目难度不大.


 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案科目:高中化学 来源: 题型:选择题
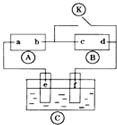 如图
如图 为直流电源,
为直流电源, 为浸透饱和氯化钠溶液和酚酞试液的滤纸,
为浸透饱和氯化钠溶液和酚酞试液的滤纸, 为电镀槽.接通电路后发现
为电镀槽.接通电路后发现 上的c点显红色.为实现铁上镀锌,接通
上的c点显红色.为实现铁上镀锌,接通 后,使c、d两点短路.下列叙述正确的是( )
后,使c、d两点短路.下列叙述正确的是( )| A. | a为直流电源的负极 | B. |  中电解质溶液为FeCl3 中电解质溶液为FeCl3 | ||
| C. | f电极为锌板 | D. | c极发生的反应为2H++2e-═H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
物质 T/℃n/mol T/℃ | 活性炭 | NO | E | F |
| T1 | 2.000 | 0.040 | 0.030 | 0.030 |
| T2 | 2.005 | 0.050 | 0.025 | 0.025 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
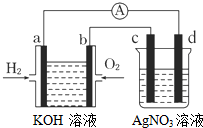 氢氧燃料电池能量转化率高,具有广阔的发展前景.现用氢氧燃料电池进行如图所示的实验(图中所用电极均为惰性电极),下列叙述正确的是( )
氢氧燃料电池能量转化率高,具有广阔的发展前景.现用氢氧燃料电池进行如图所示的实验(图中所用电极均为惰性电极),下列叙述正确的是( )| A. | a电极是负极,OH-移向正极 | |
| B. | b电极的电极反应为:O2+2H2O+4e-═4OH- | |
| C. | 燃料电池中电解质溶液的pH保持不变 | |
| D. | d电极有气体放出 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 液氯储存在钢瓶中 | B. | 新制氯水保存在黑色广口瓶中 | ||
| C. | 少量金属钠保存在煤油中 | D. | 氯化亚铁溶液加入少量的铁粉保存 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③⑤ | B. | ②③④ | C. | ①③④ | D. | ①②④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HN3水溶液中微粒浓度大小顺序为:c(HN3)>c(N${\;}_{3}^{-}$)>c(H+)>c(OH-) | |
| B. | HN3与NH3作用生成的叠氮酸铵是离子化合物 | |
| C. | NaN3水溶液中离子浓度大小顺序为:c(Na+)>c(N${\;}_{3}^{-}$)>c(OH-)>c(H+) | |
| D. | N${\;}_{3}^{-}$与CO2含相等电子数 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com