
【题目】下列描述不符合生产实际的是( )
A.电解熔融的氯化钠制取金属钠,用铁作阳极
B.电解法精炼粗铜,用纯铜作阴极
C.电解饱和食盐水制烧碱,用涂镍碳钢网作阴极
D.在锌锰干电池中,用锌作负极
 华东师大版一课一练系列答案
华东师大版一课一练系列答案科目:高中化学 来源: 题型:
【题目】实验室需配制一种仅含四种离子(不包括水电离出的离子)的无色混合溶液,且在混合溶液中四种离子的物质的量浓度均为1 mol·L1。下面四个选项中能达到此目的的是( )
A. Na+、K+、![]() 、ClB. Cu2+、K+、
、ClB. Cu2+、K+、![]() 、
、![]()
C. H+、K+、![]() 、ClD. Mg2+、Na+、Cl、
、ClD. Mg2+、Na+、Cl、![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下列变化①大气固氮②硝酸分解③实验室制取氨气中,按氮元素被氧化、被还原、既不被氧化又不被还原的顺序排列,正确的是
A.③①②B.②①③C.③②①D.①②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向Ba(OH)2和NaOH混合溶液中缓慢通入CO2至过量(溶液温度变化忽略不计),生成沉淀物质的量与通入CO2体积的关系如下图所示。下列说法不正确的是
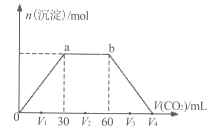
A. b点时溶质为NaHCO3
B. 横坐标轴上V4的值为90
C. V1、V2、V3时,溶液中c(Ba2+)·c(CO32-)相等
D. 原混合物中n[Ba(OH)2]:n(NaOH)=1:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2NCOONH4是工业由氨气合成尿素的中间产物。在一定温度下、体积不变的密闭容器中发生反应H2NCOONH4(s)![]() 2NH3(g)+CO2(g),能说明该反应达到平衡状态的是①每生成34g NH3的同时消耗44g CO2 ②混合气体的平均相对分子质量不变 ③NH3的体积分数保持不变 ④混合气体的密度保持不变 ⑤c(NH3):c(CO2)=2:1
2NH3(g)+CO2(g),能说明该反应达到平衡状态的是①每生成34g NH3的同时消耗44g CO2 ②混合气体的平均相对分子质量不变 ③NH3的体积分数保持不变 ④混合气体的密度保持不变 ⑤c(NH3):c(CO2)=2:1
A. ①③⑤ B. ①③④ C. ②④ D. ①④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酸钠常用作食品防腐剂。现用下图所示仪器(夹持装置已省略)及药品,探究亚硝酸钠与硫酸反应生成气体的成分。
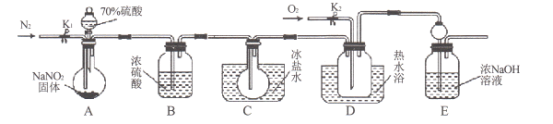
已知:N02和NO的沸点分别是21℃和-152℃。
回答下列问题:
(l)组装好仪器后,接下来进行的操作是 ___;装置C的作用是 ___。
(2)滴入硫酸前需要通入N2,其目的是 ___;实验结束后还需要继续通入N2的目的是____。
(3)关闭弹簧夹K1,打开分液漏斗活塞,滴入70%硫酸后,A中产生红棕色气体。确认A中还含有NO的依据是____;A中发生反应的化学方程式为_____。
(4)如果向D中通入过量O2,则装置E中发生反应的离子方程式为____;如果没有装置B,对实验结论造成的影响是 ___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】M是第四周期元素,最外层只有1个电子,次外层的所有原子轨道均充满电子。元素Y的负一价离子的最外层电子数与次外层的相同。回答下列问题:
(1)单质M的晶体中原子间通过______________________作用形成面心立方密堆积,其中M原子的配位数____________。
(2)元素Y的含氧酸中,酸性最强的是________________(写化学式),该酸根离子的立体构型为______________________。
(3)M与Y形成的一种化合物的立方晶胞如图所示。
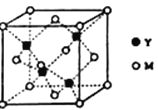
①该化合物的化学式为______________________,已知晶胞参数a=0.542 nm,此晶体的密度为__________________________g·cm–3。(只写出计算式,阿伏加德罗常数为NA)
②该化合物难溶于水但易溶于氨水,其原因是:_____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有下列九种物质:①盐酸溶液 ②石墨 ③蔗糖 ④CO2⑤熔融NaHSO4⑥Ba(OH)2固体 ⑦氨水 ⑧纯硫酸 ⑨NaCl固体
(1)属于电解质的有__________;属于非电解质的有________;能导电的物质有________。
(2)②和SiO2在高温下可发生如下反应:3C+SiO2![]() SiC+2CO↑ (已知SiC中Si元素为+4价),上述反应中还原产物是_______;氧化剂与还原剂物质的量之比为_______。
SiC+2CO↑ (已知SiC中Si元素为+4价),上述反应中还原产物是_______;氧化剂与还原剂物质的量之比为_______。
(3)上述九种物质中有两种物质之间可发生离子反应:H++OH-===H2O,该离子反应对应的化学方程式为________________________
(4)⑤的电离方程式为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】回收利用CO2是环境科学研究的热点课题,是减轻温室效应危害的重要途径。
(1)工业上,利用天然气与二氧化碳反应制备合成气(CO和H2),化学方程式为CO2(g)+CH4(g)=2CO(g)+2H2O(g)上述反应的能量变化如图1所示,该反应是________(填“吸热反应,或“放热反应”)。

(2)工业上用CO2生产甲醇(CH3OH)燃料,可以将CO2变废为宝。在体积为1L的密闭容器中,充入1molO2和4molH2,一定条件下发-反应:CO2(g)+3H2(g)=CH3OH(g)+H2O(g),测得CO2(g)和CH3OH(g)的浓度随时间变化如上图2所示。
①从反应开始到平衡,用CH3OH表示的平均反应速率为______。
②若反应CO2(g)+3H2(g)=CH3OH(g)+H2O(g)在四种不同情况下的反应速率分别为:
A.v(H2)=0.01molL-1s-1 B.v(CO2)=0.15molL-1s-1
C.v(CH3OH)=0.3molL-1min-1 D.v(H2O)=0.45molL-1min-1
该反应进行由快到慢的顺序为______(填字母)。
③下列描述能说明反应达到最大限度的是_______(填字母)。
A.混合气体的密度保持不变
B.混合气体中CH3OH的体积分数约为21.4%
C.混合气体的总质量保持不变
D.H2、CH3OH的生成速率之比为3:1
(3)甲醇(CH3OH)是一种可再生能源,具有广阔的开发和应用前景。以甲醇、氧气和KOH溶液为原料,石墨为电极制造新型手机电池,甲醇在______极反应,电极反应式为____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com