
 Mn2++Cl2↑+2H2O,
Mn2++Cl2↑+2H2O, Mn2++Cl2↑+2H2O;
Mn2++Cl2↑+2H2O;

 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:

| A、热空气能吹出溴是利用溴易挥发的性质 |
| B、SO2吸收溴的反应方程式:SO2+2H2O+Br2→H2SO4+2HBr |
| C、流程中循环利用的物质有SO2、Br2、Cl2等多种 |
| D、没有采用直接蒸馏含溴海水得到单质溴的主要原因是为了节能 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、由-CH3、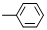 、-OH、-COOH四种原子团两两组合形成的有机物中,属于弱电解质的有4种 、-OH、-COOH四种原子团两两组合形成的有机物中,属于弱电解质的有4种 | ||
B、某种兴奋剂的结构简式如图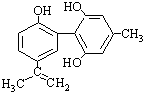 ,1mol该物质与浓溴水反应时最多消耗Br2为6mol ,1mol该物质与浓溴水反应时最多消耗Br2为6mol | ||
C、有机物X、Y、M的转化关系为:淀粉→X→Y
| ||
D、高分子化合物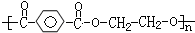 ,其链节为对苯二甲酸和乙二醇 ,其链节为对苯二甲酸和乙二醇 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、混合前一元酸HA的c(H+)=0.1 mol?L-1 |
| B、该混合溶液中:c(Na+)>c(A-)>c(OH-)>c(H+) |
| C、HA在水溶液中的电离方程式:HA=H++A- |
| D、该混合溶液中:c(A-)+c(HA)=0.1 mol?L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A-B | A=B | C-B | C=B | |
| 键能:/kJ?mol-1 | 360 | 803 | 464 | 640 |
查看答案和解析>>
科目:高中化学 来源: 题型:
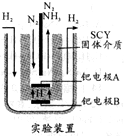 氨是一种重要的化工原料,氨的合成和应用是当前的重要研究内容之一.
氨是一种重要的化工原料,氨的合成和应用是当前的重要研究内容之一.| 1 |
| 2 |
| 时间/min | 5 | 10 | 15 | 20 | 25 | 30 |
| c(NH3)/(mol.L-l) | 0.08 | 0.14 | 0.18 | 0.20 | 0.20 | 0.20 |
查看答案和解析>>
科目:高中化学 来源: 题型:
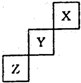
| A、相同条件下,三种元素的单质跟氢气反应时,X单质最剧烈 |
| B、Y的气态氢化物稳定性比Z的气态氢化物的稳定性强 |
| C、ZO2能与Z的最高价氧化物对应的水化物反应生成Z单质 |
| D、由氢、氧和Z元素形成的常见化合物中既含有离子键又含有共价键 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com