
短周期元素 X、Y、Z 可组成化学式为 XYZ3 的四种化合物甲、乙、丙、丁.
(l)若甲中 X 的原子只有一个质子,Y、Z同周期,画出Z的电子排布图为 .
(2)若乙中X、Y、Z 三种元素的原子序数之和为 26,Y、Z 同周期,且乙是一种微溶于水的盐,并写出工业制备单质X的化学方程式: .
(3)若丙中X元素的焰色反应为黄色,Y与X同周期,Y 是同周期中原子半径最小的元素,丙与浓盐酸反应生成 Y 单质的化学方程式为 .
(4)若丁中 X、Y、Z 处于不同周期,X的族序数是周期序数的二倍,Z原子核外电子占有9个轨道,且具有一个未成对电子,则丁的结构式为 .
考点:
位置结构性质的相互关系应用.
专题:
元素周期律与元素周期表专题.
分析:
(1)X的原子只有一个质子,为H元素,短周期元素 X、Y、Z 可组成化学式为 XYZ3 的化合物,在化合物中H显+1价,Y为+5价,Z是﹣2价,Y、Z同周期,则Y是N元素,Z是O元素;
(2)若乙中X、Y、Z 三种元素的原子序数之和为26,Y、Z 同周期,且乙是一种微溶于水的盐,且X、Y、Z是短周期元素,则乙是碳酸镁,X是镁,Y是C 元素,Z是O元素,活泼金属采用电解其熔融盐的方法冶炼;
(3)若丙中X元素的焰色反应为黄色,则X是钠元素,Y与X同周期,Y是同周期中原子半径最小的元素,则Y是Cl元素,短周期元素 X、Y、Z 可组成化学式为 XYZ3 的盐,所以丙是氯酸钠,则Z是O元素,根据反应物和生成物写出反应方程式;
(4)若丁中 X、Y、Z 处于不同周期,Z原子核外电子占有9个轨道,且具有一个未成对电子,则Z是Cl元素,X的族序数是周期序数的二倍,则X是C元素,Y是H元素,则丁是三氯甲烷,根据丁的结构写出其结构式.
解答:
解:(1)X的原子只有一个质子,为H元素,短周期元素 X、Y、Z 可组成化学式为 XYZ3 的化合物,在化合物中H显+1价,Y为+5价,Z是﹣2价,Y、Z同周期,则Y是N元素,Z是O元素,Z原子核外有8个电子,根据构造原理知,Z的电子排布图为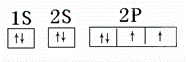 ,故答案为:
,故答案为: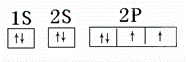 ;
;
(2)若乙中X、Y、Z 三种元素的原子序数之和为26,Y、Z 同周期,且乙是一种微溶于水的盐,且X、Y、Z是短周期元素,则乙是碳酸镁,X是镁,Y是C 元素,Z是O元素,工业上采用电解熔融氯化镁的方法冶炼镁,其反应方程式为MgCl2 Mg+Cl2↑,故答案为:MgCl2
Mg+Cl2↑,故答案为:MgCl2 Mg+Cl2↑;
Mg+Cl2↑;
(3)若丙中X元素的焰色反应为黄色,则X是钠元素,Y与X同周期,Y是同周期中原子半径最小的元素,则Y是Cl元素,短周期元素 X、Y、Z 可组成化学式为 XYZ3 的盐,所以丙是氯酸钠,则Z是O元素,氯酸钠和浓盐酸反应生成氯化钠、氯气和水,反应方程式为:NaClO3+6HCl(浓)=3Cl2↑+NaCl+3H2O,
故答案为:NaClO3+6HCl(浓)=3Cl2↑+NaCl+3H2O;
(4)若丁中 X、Y、Z 处于不同周期,Z原子核外电子占有9个轨道,且具有一个未成对电子,则Z是Cl元素,X的族序数是周期序数的二倍,则X是C元素,Y是H元素,则丁是三氯甲烷,三氯甲烷是四面体结构,其结构式为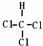 ,故答案为:
,故答案为: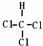 .
.
点评:
本题考查位置结构及其关系,正确推断元素是解本题的关键,充分利用所给信息进行分析判断,难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
下列热化学方程式中△H的绝对值能表示可燃物的燃烧热的是( )
|
| A. | H2(g)+Cl2(g)=2HCl(g);△H=﹣184.6kJ/mol |
|
| B. | CH4(g)+2O2(g)=CO2(g)+2H2O(g);△H=﹣802.3kJ/mol |
|
| C. | 2H2(g)+O2(g)=2H2O(l);△H=﹣571.6kJ/mol |
|
| D. | CO(g)+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
一定温度下,在容积固定的密闭容器中进行可逆反应:2NO2⇌2NO+O2,达到平衡的标志是( )
①相同时间内,氧气的生成速率为n mol•L﹣1•s﹣1,NO2的生成速率为2n mol•L﹣1•s﹣1
②单位时间内生成n mol O2的同时生成2n mol的NO
③混合气体的颜色不再变化
④混合气体的密度保持不变
⑤混合气体的平均相对分子质量不再改变
⑥压强不随时间变化而变化.
|
| A. | ①③⑤⑥ | B. | ②③⑤ | C. | ①③④ | D. | ①②③④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组热化学方程式程中,化学反应的△H前者大于后者的是( )
①CaCO3(s)=CaO(s)+CO2(g)△H1 CaO(s)+H2O(l)=Ca(OH)2(s)△H2
②C(s)+O2(g)=CO2(g)△H3C(s)+1/2O2(g)=CO(g)△H4
③S(s)+O2(g)=SO2(g)△H5S(g)+O2(g)=SO2(g)△H6.
|
| A. | ①③ | B. | ①② | C. | ②③ | D. | ①②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列图示与对应的叙述相符的是( )
|
| A. | 图a为碱式滴定管,可盛装NaOH、KMnO4等溶液,不可盛装酸性液体 |
|
| B. | 图b中曲线表示反应2A(g)+B(g)⇌2C(g)△H>0,正、逆反应的平衡常数K随温度的变化 |
|
| C. | 图c表示铜的精炼,则X是精铜,Y是粗铜,Z是CuSO4溶液 |
|
| D. | 图d表示25℃时,CaSO4在水中的沉淀溶解平衡曲线.向100 mL该条件下的CaSO4饱和溶液中加入100 mL 0.01mol•L﹣1的Na2SO4溶液有沉淀析出 |
查看答案和解析>>
科目:高中化学 来源: 题型:
已知NaHSO4在水中的电离方程式为NaHSO4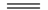 Na+ + H++
Na+ + H++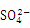 。某温度下,向pH=6的蒸馏水中加入NaHSO4晶体,保持温度不变,测得溶液的pH=2。对于该溶液,下列叙述中不正确的是
。某温度下,向pH=6的蒸馏水中加入NaHSO4晶体,保持温度不变,测得溶液的pH=2。对于该溶液,下列叙述中不正确的是
A.该温度高于25℃
B.水电离出来的c(H+)= 1×10-10 mol • L﹣1
C.c(H+)=c(OH-))+c(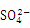 )
)
D.该温度下加入等体积pH为12的NaOH溶液可使反应后的溶液恰好呈中性
查看答案和解析>>
科目:高中化学 来源: 题型:
高氯酸三碳酰肼合镍{[Ni(CHZ)3](ClO4)2 }是一种新型的起爆药。
(1)Ni2+基态核外电子排布式为 。
(2)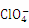 的空间构型是 ;与
的空间构型是 ;与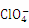 互为等电子体的一种分子为 (填化学式)。
互为等电子体的一种分子为 (填化学式)。
(3)化学式中CHZ为碳酰肼,组成为CO(N2H3)2,碳酰肼中碳原子的杂化轨道类型为 ;1molCO(N2H3)2分子中含有σ键数目为 。
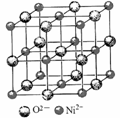
(4)高氯酸三碳酰肼合镍可由NiO、高氯酸及碳酰肼化合而成。NiO的晶胞结构如图所示,晶胞中含有的Ni2+数目为a,Ni2+的配位数为b,NiO晶体中每个镍离子距离最近的镍离子数目为c,则a∶b∶c= 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下表为元素周期表前四周期的一部分,下列有关R、W、X、 Y、Z五种元素的叙述中,正确的是
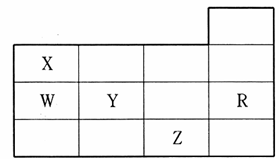
A.常压下,五种元素的单质中,Z单质的沸点最高
B.Y、Z的阴离子电子层结构都与R原子的相同
C.W的氢化物的沸点比X的氢化物的沸点高
D.Y元素的非金属性比W元素的非金属性强
查看答案和解析>>
科目:高中化学 来源: 题型:
下列与有机物结构、性质相关的叙述错误的是( )
|
| A. | 乙酸分子中含有羧基,可与NaHCO3溶液反应生成CO2 |
|
| B. | 蛋白质和油脂都属于高分子化合物,一定条件下都能水解 |
|
| C. | 甲烷和氯气反应生成一氯甲烷与苯和硝酸反应生成硝基苯的反应类型相同 |
|
| D. | 苯不能使溴的四氯化碳溶液褪色,说明苯分子中没有乙烯分子中类似的碳碳双键 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com