
分析 根据ρ=$\frac{m}{V}$可知体积相同时,二者密度与质量成正比;标况下二者体积相同,则A与B的物质的量相同,根据M=$\frac{m}{n}$可知二者摩尔质量与其质量成正比,同质量的A与B分子个数之比等于摩尔质量的反比.
解答 解:标况下,mg 气体A和ng气体B具有相等的体积,根据ρ=$\frac{m}{V}$可知同温同压下的密度与质量成正比,则二者密度之比=mg:ng=m:n;
标况下二者体积相同,则A与B的物质的量相同,根据M=$\frac{m}{n}$可知二者摩尔质量与其质量成正比,则二者摩尔质量之比=m:n,根据n=$\frac{m}{M}$=$\frac{N}{{N}_{A}}$可知,相同质量的A、B含有分子数与其摩尔质量成正比,则同质量的A、B的分子数目之比为n:m,
故答案为:m:n; n:m.
点评 本题考查了物质的量的计算,题目难度不大,明确物质的量与气体摩尔体积、阿伏伽德罗常数、摩尔质量等物理量之间的关系为解答关键,试题培养了学生的化学计算能力.


 智慧课堂密卷100分单元过关检测系列答案
智慧课堂密卷100分单元过关检测系列答案 单元期中期末卷系列答案
单元期中期末卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 用湿润的pH试纸测定溶液的pH,测定结果偏小,该溶液一定呈酸性 | |
| B. | 用pH试纸分别测定氯水和盐酸的pH值,比较两溶液的酸性强弱 | |
| C. | 取同体积不同浓度的醋酸和盐酸加水稀释相同倍数,测定稀释前后pH值的变化,以此区别这两种酸 | |
| D. | 测定硫酸型酸雨的pH值时,取样后应立即测定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 进行萃取操作时,应选择有机萃取剂,且萃取剂的密度要比水大 | |
| B. | 进行蒸馏操作时,应使温度计的水银球靠近蒸馏烧瓶的瓶口处 | |
| C. | 进行分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 | |
| D. | 进行蒸发操作时,应将蒸发皿中溶液蒸干后,再停止加热 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe分别与氯气和稀盐酸反应所得氯化物相同 | |
| B. | 等量的Zn分别与足量的稀硫酸和浓硫酸反应所得气体体积相同 | |
| C. | Li、Na、K的原子半价和熔沸点随原子序数的增加而增大 | |
| D. | P、C、S、Cl的最高价氧化物对应水化物的酸性逐渐增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径大小顺序:W>Z>Y>X | |
| B. | X、Y、W都能与氧元素形成两种氧化物 | |
| C. | W的最高价氧化物的水化物的酸性比Z的弱 | |
| D. | W分别与X、Y形成的化合物中化学键类型相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2SO3溶液使酸性高锰酸钾溶液褪色:5SO32-+6H++2MnO4-=5SO42-+2Mn2++3H2O | |
| B. | 铵明矾溶液中加入过量的氢氧化钡溶液:Al3++2SO42-+2Ba2++4OH-═2BaSO4↓+AlO2-+2H2O | |
| C. | 向碳酸氢钙溶液中加入过量氢氧化钠溶液:Ca 2++2HCO 3 -+2OH -=BaCO 3↓+CO 3 2- 十2H 2 O | |
| D. | 弱酸尼泊金酸( 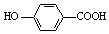 )与碳酸氢钠溶液反应: )与碳酸氢钠溶液反应: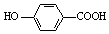 +HCO3-→ +HCO3-→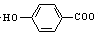 -+CO2↑+H2O -+CO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
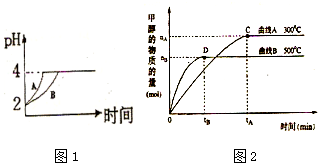 化学学科中的平衡理论主要包括:化学平衡、电离平衡、水解平衡和溶解平衡四种,且均符合勒夏特列原理.请回答下列问题:
化学学科中的平衡理论主要包括:化学平衡、电离平衡、水解平衡和溶解平衡四种,且均符合勒夏特列原理.请回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com