
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| 温度/℃ | 10 | 20 | 30 | 40 | 50 |
| (NH4)2SO4/g | 73.0 | 75.4 | 78.0 | 81.0 | 84.5 |
| FeSO4?7H2O/g | 40.0 | 48.0 | 60.0 | 73.3 | - |
| (NH4)2SO4?FeSO4?6H2O/g | 18.1 | 21.2 | 24.5 | 27.9 | 31.3 |

查看答案和解析>>
科目:高中化学 来源: 题型:
| 温度/℃ | 10 | 20 | 30 | 40 | 50 |
| (NH4)2SO4/g | 73.0 | 75.4 | 78.0 | 81.0 | 84.5 |
| FeSO4?7H2O/g | 40.0 | 48.0 | 60.0 | 73.3 | - |
| (NH4)2SO4?FeSO4?6H2O/g | 18.1 | 21.2 | 24.5 | 27.9 | 31.3 |

查看答案和解析>>
科目:高中化学 来源:物理教研室 题型:022
(1)用90%H2SO4溶解钛铁矿(FeTiO3),反应式为
FeTiO3+3H2SO4====FeSO4+Ti(SO4)2+3H2O
在除去不溶性杂质后,结晶析出FeSO4·TH2O时,为了保持较高的酸度不能加水,其原因可能是( )
A.防止Fe2+被氧化 B.防止Ti(SO4)2水解
C.减少FeSO4·TH2O的溶解 D.减少Ti(SO4)2的溶解量
(2)在除去杂质后,又需加入大量的水稀释以降低酸度,同时加热以生成TiO(OH)2沉淀,过滤,将TiO(OH)2热分解即得钛白粉(TiO2).除杂后加水稀释和加热的目的是__________
______________.
(3)在高温气流中,TiO2可转化为TiCl4,反应方程式为________________________.
(4)将TiCl4与Na共溶即可得Ti,反应式为________________________,若用TiCl4溶液与Na反应制Ti,不能达到预期目的,原因是________________________.
查看答案和解析>>
科目:高中化学 来源:2013-2014学年广东省等高三下学期2月联考理综化学试卷(解析版) 题型:填空题
二氧化铈(CeO2)是一种重要的稀土氧化物。平板电视显示屏生产过程中产生大量的废玻璃粉末(含SiO2、Fe2O3、CeO2以及其他少量可溶于稀酸的物质)。某课题组以此粉末为原料回收铈,设计实验流程如下:
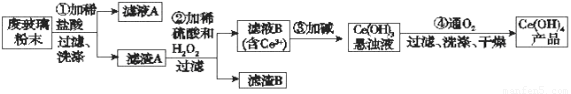
(1)洗涤滤渣A的目的是为了除去____________(填离子符号),检验该离子是否洗净的方法是_________________________________________________________。
(2)第②步反应的离子方程式是______________________________________,滤渣B的主要成分是___________________。
(3)萃取是分离稀土元素的常用方法,已知化合物TBP作为萃取剂能将铈离子从水溶液中萃取出来,TBP______________(填“能”或“不能”)与水互溶。实验室进行萃取操作时用到的主要玻璃仪器有_______________、烧杯、玻璃棒、量筒等。
(4)取上述流程中得到的Ce(OH)4产品0.536 g,加硫酸溶解后,用0.100 0 mol·L-1 FeSO4标准溶液滴定至终点时(铈被还原为Ce3+),消耗25.00 mL标准溶液。该产品中Ce(OH)4的质量分数为___________(结果保留两位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
(11分)以下是25℃时几种难溶电解质的溶解度:
难溶电解质 | Mg(OH)2 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
溶解度/g | 9×10-4 | 1.7×10-6 | 1.5×10-4 | 3.0×10-9 |
在无机化合物的提纯中,常利用难溶电解质的溶解平衡原理除去某些杂质。例如:
①为了除去氯化铵中的杂质FeCl3,先将混合物溶于水,再加入一定量的试剂充分反应后,过滤结晶即可;
②为了除去氯化镁晶体中的杂质FeCl3,先将混合物溶于水,加人足量的氢氧化镁,充分反应后,过滤结晶即可;
③为了除去硫酸铜晶体中的杂质FeSO4,先将混合物溶于水,加入一定量的酸性H2O2溶液,将Fe2+化成Fe3+后,调升溶液的pH=4后,过滤结晶即可。
请回答下列问题:
(1)上述三个除杂方案都能够达到很好效果,Fe2+、Fe3+都被转化为 (填化学式)而除去。
(2)①中加入的试剂应该选择 为宜,其原因是 。
(3)②中除去FeCl3,所发生反应的离子方程式为 。
(4)下列与方案③相关的叙述中,正确的是 (填字母序号)。
A.H2O2是绿色氧化剂,在氧化过程中不引进杂质、不产生污染
B.将Fe2+氧化为Fe3+的主要原因是Fe(OH)2沉淀比Fe(OH)3沉淀较难过滤
C.调升溶液pH=4可选择的试剂是氢氧化铜
D.Cu2+不能大量存在于pH=4的溶液中
E.在pH>4的溶液中Fe3+一定不能大量存在
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com