
学与环境密切相关,下列有关说法正确的是 ( )
A.CO2属于大气污染物
B.酸雨是pH小于7的雨水
C.CO2、NO2或SO2都会导致酸雨的形成
D.大气中CO2含量的增加会导致温室效应加剧
科目:高中化学 来源: 题型:
在呼吸面具和潜水艇中可用过氧化钠作为供氧剂.请选用适当的化学试剂和实验用品,用图中的实验装置进行实验,证明过氧化钠可作供氧剂。
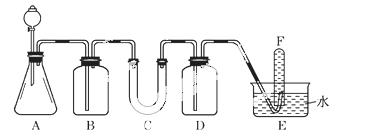
(1)A是制取CO2的装置.写出A中发生反应的化学方程式:________________________________.
(2)填写表中空格:
| 仪器 | 加入试剂 | 加入该试剂的目的 |
| B | 饱和NaHCO3溶液 | |
| C | ||
| D |
(3)写出过氧化钠与二氧化碳反应的化学方程式:______________________
____________________________________________________________________.
(4)试管F中收集满气体后,下一步实验操作是:____________________________________
________________________________________________________________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
2010年2月10日中国经济网发布的《第一次全国污染源普查公报》一文中有如下一组 数据:
数据:
| 工业废气中主要污染物 | SO2 | 烟尘 | NOx | 粉尘 |
| 污染物产生量(万吨/年) | 4 345.42 | 48 927.22 | 1 223.97 | 14 731.4 |
| 污染物排放量(万吨/年) | 2 119.75 | 982.01 | 1 188.44 | 764.68 |
下列有关说法中错误的是( )
A.SO2、NOx的大量排放会导致酸雨的发生
B.煤与石油的大量燃烧是造成SO2、NOx大量排放的主要因素
C.烟尘、粉尘属于固体污染物
D.人类活动产生的气态污染物能全部进入大气中
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,下列各组物质中,Y既能与X反应又能与Z反应的是
| X | Y | Z | |
| ① | NaOH溶液 | Al(OH)3 | 稀硫酸 |
| ② | KOH溶液 | SiO2 | 稀盐酸 |
| ③ | O2 | N2 | H2 |
| ④ | FeCl3溶液 | Cu | 浓硝酸 |
A.①③ B.①④ C.②④ D.②③
查看答案和解析>>
科目:高中化学 来源: 题型:
用右图所示装置进行下列实验,实验结果与预测的现象不
一致的是
| ①中的物质 | ②中的物质 |
| |
| A | KI溶液 | 浓硝酸 | 溶液变蓝色 |
| B | 酚酞溶液 | 浓氨水 | 无色变红色 |
| C | NaAlO2溶液 | 浓盐酸 | 有白色沉淀 |
| D | 湿润红布条 | 饱和氯水 | 红布条褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
已知a、e、H为三种由短周期元素构成的粒子,它们都有10个电子,其结构特点如下:
| 粒子代码 | a | e | H |
| 原子核数 | 单核 | 两核 | 四核 |
| 粒子的电荷数 | 一个单位正电荷 | 一个单位负电荷 | 0 |
(1)请写出H的电子式__________________。
物质A由a、e构成,B、C、D都是单质,各有关物质之间 的相互反应转化关系如下图所示,反应①~⑥是用于工业生产的反应。
的相互反应转化关系如下图所示,反应①~⑥是用于工业生产的反应。
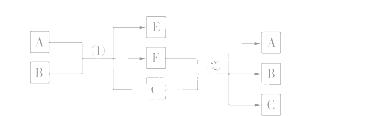
(2)写出②反应的离子方程式:____________。
(3)反应②用于工业生产时为了防止B和C混合反应产生危险,所使用的一种特殊材料的名称为____________。
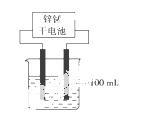
(4)实验室模拟工业反应②的过程如右图所示,标准状况下,当电极上产生112 mL B气体时假设气体完全逸出,溶液体积不变,烧杯中溶液中pH=________。
C、D单质可以发生如下一系列反应,I和J的相对分子质量之差为16,K是重要的化工原料。
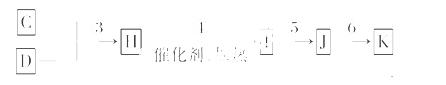
(5)在工业生产中,1 mol H最终转化为1 mol K时,转移电子的物质的量为________。
(6)L是由3种元素构成的分子,能与H以1∶2的物质的量之比反应生成尿素CONH22和HCl,则L的结构式为________________。
(7)E(溶液)能与H以1∶2的物质的量之比反应生成N、F和G,N中各原子均已达到稀有气体的稳定结构,则N的分子式为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
难溶性杂卤石(K2SO4·MgSO4·2CaSO4·2H2O)属于“呆矿”,在水中存在如下平衡:
K2SO4·MgSO4·2CaSO4·2H2O(s)2Ca2++2K++Mg2++4SO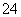 +2H2O
+2H2O
为能充分利用钾资源,用饱和Ca(OH)2溶液溶浸杂卤石制备硫酸钾,工艺流程如下:
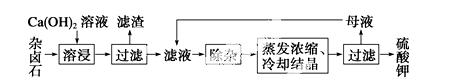
(1)滤渣主要成分有________和________以及未溶杂卤石。
(2)用化学平衡移动原理解释Ca(OH)2溶液能溶解杂卤石浸出K+的原因:_________________。
(3)“除杂”环节中,先加入________溶液,经搅拌等操作后,过滤,再加入_________溶液调滤液pH至中性。
 (4)不同温度下,K+的浸出浓度与溶浸时间的关系见右图。
(4)不同温度下,K+的浸出浓度与溶浸时间的关系见右图。
由图可得,随着温度升高,
①________________,
②__________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com