
 H2(g)+I2(g)。若HI浓度由0.1 mol·L-1降到0.07 mol·L-1时,需要15 s,那么HI浓度由0.07 mol·L-1降到0.05 mol·L-1时所需反应的时间为
H2(g)+I2(g)。若HI浓度由0.1 mol·L-1降到0.07 mol·L-1时,需要15 s,那么HI浓度由0.07 mol·L-1降到0.05 mol·L-1时所需反应的时间为| A.等于5 s | B.大于10 s | C.等于10 s | D.小于10 s |
 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案科目:高中化学 来源:不详 题型:单选题

 、
、查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题


 。
。查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
 2SO3(g) ΔH=-196.6 kJ·mol-1),请回答下列问题:
2SO3(g) ΔH=-196.6 kJ·mol-1),请回答下列问题:
 2H2↑+O2↑
2H2↑+O2↑ 2H2+O2
2H2+O2 2H2↑+O2↑
2H2↑+O2↑ CO+3H2
CO+3H2 CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1,测得CO2和CH3OH(g)浓度随时间变化如图2所示。从3 min到9 min,v(H2)=________mol·L-1·min-1。
CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1,测得CO2和CH3OH(g)浓度随时间变化如图2所示。从3 min到9 min,v(H2)=________mol·L-1·min-1。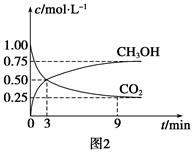
 CH3OH(g)的平衡常数。下列说法正确的是________。
CH3OH(g)的平衡常数。下列说法正确的是________。| 温度/℃ | 0 | 100 | 200 | 300 | 400 |
| 平衡常数 | 667 | 13 | 1.9×10-2 | 2.4×10-4 | 1×10-5 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.任何一个氧化还原反应都可以设计为电池,输出电能 |
| B.铅蓄电池放电时的负极和充电时的阴极均发生氧化反应 |
| C.电解饱和食盐水的过程中,水的电离平衡正向移动 |
| D.任何可逆反应,其平衡常数越大,反应速率、反应物的转化率就越大 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
| 温度/℃ | 15 | 20 | 25 | 30 | 35 | 40 | 45 |
| NaClO浓度/mol·L-1 | 4.6 | 5.2 | 5.4 | 5.5 | 4.5 | 3.5 | 2 |

查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
| T/K | 303 | 313 | 323 | 353 |
| NH3生成量/(10-6 mol) | 4.8 | 5.9 | 6.0 | 2.0 |
 4NH3(g)+3O2(g)ΔH=a kJ·mol-1
4NH3(g)+3O2(g)ΔH=a kJ·mol-1 2NH3(g) ΔH=-92 .4 kJ·mol-1
2NH3(g) ΔH=-92 .4 kJ·mol-1 2NH3(g) ΔH=-92 .4 kJ·mol-1,分别研究在T1、T2和T3(T1<T2<T3)三种温度下合成氨气的规律。下图是上述三种温度下不同的H2和N2的起始组成比(起始时N2的物质的量均为1 mol)与N2平衡转化率的关系。请回答:
2NH3(g) ΔH=-92 .4 kJ·mol-1,分别研究在T1、T2和T3(T1<T2<T3)三种温度下合成氨气的规律。下图是上述三种温度下不同的H2和N2的起始组成比(起始时N2的物质的量均为1 mol)与N2平衡转化率的关系。请回答:
 N2(g)+3H2(g)的平衡常数为________ 。
N2(g)+3H2(g)的平衡常数为________ 。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 xC(g)+D(g),5min后反应达到平衡,容器内压强变小,测得D的平均反应速率为0.05mol?L-1?min-1 ,下列结论错误的是( )
xC(g)+D(g),5min后反应达到平衡,容器内压强变小,测得D的平均反应速率为0.05mol?L-1?min-1 ,下列结论错误的是( ) | A.A的平均反应速率为0.15 mol?L-1?min-1 |
| B.平衡时,C的浓度为0.25mol?L-1 |
| C.B的平均反应速率为0.1 mol?L-1?min-1 |
| D.平衡时,容器内压强为原来的0.875倍 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com