
下列陈述中,Ⅰ、Ⅱ都正确且两者间具有因果关系的一组是
选项 | 陈述Ⅰ | 陈述Ⅱ |
A | FeCl3溶液能腐蚀Cu | Fe的金属性强于Cu |
B | Na2O2使酚酞溶液变红 | Na2O2是碱性氧化物 |
C | Cl2可部分与水反应 | 用排饱和食盐水法收集Cl2 |
D | 浓H2SO4可干燥NO和SO2 | NO和SO2还原性都弱 |
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源:2013-2014广东省湛江市高三年级第二次模拟理综化学试卷(解析版) 题型:选择题
常温下关于0.l mol·L-1氯化铵溶液的说法错误的是( )
A.c(Cl-)>c(NH4+)>c(H+)>c(OH-) B.加入氨水至pH=7, c(NH4+)>c(C1-)
C.滴加浓盐酸可能有,c(NH4+) = c(H+) D.加入少量CH3COONa固体,c(NH4+)减小
查看答案和解析>>
科目:高中化学 来源:2013-2014广东省深圳市高三六校4月联考理综化学试卷(解析版) 题型:填空题
(本题16分)降低大气中CO2的含量和有效地开发利用CO2正成为研究的主要课题。
(1)已知在常温常压下:
① 2CH3OH(l) + 3O2(g) = 2CO2(g) + 4H2O(g) ΔH =-1275.6 kJ/mol
② 2CO (g)+ O2(g) = 2CO2(g) ΔH =-566.0 kJ/mol
③ H2O(g) = H2O(l) ΔH =-44.0 kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式: 。
(2)在容积为2L的密闭容器中,充入2mol CO2和6mol H2,在温度500℃时发生反应:
CO2(g)+ 3H2(g) CH3OH(g)+ H2O(g) △H<0。CH3OH的浓度随时间变化如图。回答有关问题:
CH3OH(g)+ H2O(g) △H<0。CH3OH的浓度随时间变化如图。回答有关问题:

①从反应开始到20分钟时,H2的平均反应速率v(H2)=_________________。
②从30分钟到35分钟达到新的平衡,改变的条件可能是 。
A. 增大压强 B.加入催化剂 C.升高温度 D.增大反应物的浓度
③列式计算该反应在35分钟达到新平衡时的平衡常数(保留2位小数)
④如果在30分钟时,再向容器中充入2mol CO2和6mol H2,保持温度不变,达到新平衡时,CH3OH的浓度____________1mol.L-1(填“>”、“<”或“=”)。
(3)一种原电池的工作原理为:2Na2S2 + NaBr3  Na2S4 + 3NaBr。用该电池为电源,以氢氧化钾水溶液作电解质进行电解,使CO2在铜电极上可转化为甲烷。
Na2S4 + 3NaBr。用该电池为电源,以氢氧化钾水溶液作电解质进行电解,使CO2在铜电极上可转化为甲烷。
①该电池负极的电极反应式为: 。
②电解池中产生CH4一极的电极反应式为: 。
(4)下图是NaOH吸收CO2后某种产物的水溶液在pH从0至14的范围内H2CO3、HCO3-、CO32-三种成分平衡时的组成分数。

下列叙述正确的是 。
A.此图是1.0 mol·L-1碳酸钠溶液滴定1.0 mol·L-1 HCl溶液的滴定曲线
B.在pH分别为6.37及10.25时,溶液中c(H2CO3)=c(HCO3-)=c(CO32-)
C.人体血液的pH约为7.4,则CO2在血液中多以HCO3-形式存在
D.若用CO2和NaOH反应制取NaHCO3,宜控制溶液的pH为7~9之间
查看答案和解析>>
科目:高中化学 来源:2013-2014广东省深圳市高考预测理综化学试卷(解析版) 题型:选择题
X、Y、Z、W是元素周期表前四周期中的常见元素。其相关信息如下表:
元素 | 相关信息 |
X | X的一种核素的质量数为14,中子数为8 |
Y | Y与X同周期,且它的一种氧化物只能用排水法收集 |
Z | Z的单质常温下为黄绿色气体 |
W | W的原子核外电子总数是其电子层数的4倍 |
下列说法正确的是
A.原子半径:W> X>Y,离子半径:W>Z
B.氧化物对应的水化物的酸性:Z> Y>X
C.Y的最高正价含氧酸,可由它的氢化物为原料来制取
D.W的单质与X的一种氧化物不能发生置换反应
查看答案和解析>>
科目:高中化学 来源:2013-2014广东省高考预测理综化学试卷二(解析版) 题型:填空题
(本题16分)
(1)为了减轻汽车尾气造成的大气污染,人们开始探索利用NO和CO在一定条件下转化为两种无毒气体E和F的方法(已知该反应△H<0). 在2 L密闭容器中加入一定量NO和CO,当温度分别在T1和T2时,测得各物质平衡时物质的量如下表:
T/℃ n/mol | NO | CO | E | F |
初始 | 0.100 | 0.100 | 0 | 0 |
T1 | 0.020 | 0.020 | 0.080 | 0.040 |
T2 | 0.010 | 0.010 | 0.090 | 0.045 |
①请结合上表数据,写出NO与CO反应的化学方程式 .
②根据表中数据判断,温度T1和T2的关系是(填序号)__________。
A.T1>T2B.T1<T2 C.T1=T2 D.无法比较
(2)已知:4NH3(g) + 3O2(g) = 2N2(g) + 6H2O(g); ΔH= - 1266.8 kJ/mol
N2(g) + O2(g) = 2NO(g) ; ΔH = + 180.5kJ/mol,
则氨催化氧化的热化学方程式为________________________________________。
(3)500℃下,在A、B两个容器中均发生合成氨的反应。隔板Ⅰ固定不动,活塞Ⅱ可自由移动。
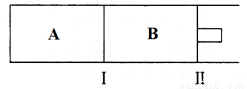
当合成氨在容器B中达平衡时,测得其中含有1.0molN2,0.4molH2,0.4molNH3,此时容积为2.0L。则此条件下的平衡常数为___________;保持温度和压强不变,向此容器中通入0.36molN2,平衡将___________(填“正向”、“逆向”或“不”)移动。
(4)在相同的密闭容器中,用方法Ⅱ和方法Ⅲ制得的两种Cu2O分别进行催化分解水的实验:
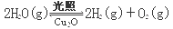 ΔH >0
ΔH >0
水蒸气的浓度(mol·L-1)随时间t (min)变化如下表:
序号 | 温度 | 0 | 10 | 20 | 30 | 40 | 50 |
① | T1 | 0.050 | 0.0492 | 0.0486 | 0.0482 | 0.0480 | 0.0480 |
② | T1 | 0.050 | 0.0488 | 0.0484 | 0.0480 | 0.0480 | 0.0480 |
③ | T2 | 0.10 | 0.094 | 0.090 | 0.090 | 0.090 | 0.090 |
可以判断:实验①的前20 min的平均反应速率 ν(O2)= ;催化剂的催化效率:实验① 实验②(填“>”、“<”)。
(5)最新研究发现,用隔膜电解法可以处理高浓度乙醛废水。原理:使用惰性电极和乙醛-Na2SO4溶液为电解质溶液,乙醛分别在阴、阳极转化为乙醇和乙酸。
总反应为:2CH3CHO+H2O CH3CH2OH+CH3COOH。
CH3CH2OH+CH3COOH。
过程中,两极除分别生成乙酸和乙醇外,均产生无色气体,阳极电极反应分别为:
4OH--4e-═O2↑+2H2O; 。
查看答案和解析>>
科目:高中化学 来源:2013-2014广东省江门市高二调研测试理综化学试卷(解析版) 题型:填空题
3,5—二甲氧基苯酚是重要的有机合成中间体,其合成反应如下:

该反应后的混合物含有:3,5—二甲氧基苯酚、甲醇、水和HCl。
已知:甲醇、乙醚和3,5—二甲氧基苯酚的部分物理性质如下表:
物质 | 沸点/℃ | 熔点/℃ | 密度(20℃)/(g/cm3) | 溶解性 |
甲醇 | 64.7 | — | 0.7915 | 易溶于水 |
乙醚 | 34.5 | — | 0.7138 | 难溶于水 |
3,5—二甲氧基苯酚 | 172 | 36 | — | 易溶于甲醇、乙醚, 微溶于水 |
现在实验室对反应后的混合物进行分离提纯:
(1)利用与其它物质 差异较大的特点,可先用蒸馏法分离出甲醇,蒸馏操作时使用的玻璃仪器有:酒精灯、 、温度计、冷凝管 、接引管、锥形瓶。
(2)①蒸馏出甲醇后,加入乙醚进行 、 操作,有机层在分液漏斗的 层。
②双项选择:选用乙醚这种试剂的主要原因是( )
A.乙醚易挥发
B.3,5—二甲氧基苯酚在乙醚中溶解度大于在水中的溶解度
C.乙醚难溶于水
D.3,5—二甲氧基苯酚熔点较低
(3)经上述步骤分离得到的有机层再用饱和NaHCO3溶液洗涤,其目的是 。
(4)洗涤完成后,加入无水CaCl2干燥,过滤除去干燥剂,蒸馏除去乙醚,得到固体产物,为进一步提纯固体产物还要进行 操作。
查看答案和解析>>
科目:高中化学 来源:2013-2014广东省江门市高二调研测试理综化学试卷(解析版) 题型:选择题
在25℃的条件下,下列叙述正确的是
A.将稀氨水逐滴加入稀硫酸中,当溶液的pH=7时,c(SO )= c(NH4+)
)= c(NH4+)
B.pH=3的醋酸溶液,稀释至原体积的10倍后pH=4
C.pH=11的NaOH溶液与pH=3的醋酸溶液等体积混合,溶液pH<7
D.向0.1mol·L-1的氨水中加入少量硫酸铵固体,则溶液中c(OH-) 增大
查看答案和解析>>
科目:高中化学 来源:2013-2014广东省梅州市高一下学期期中化学试卷(解析版) 题型:选择题
下列叙述中错误的是 ( )
A.原子半径:Cl>S>O B.还原性:Na>Mg>Al
C.稳定性:HF>HCl>HBr D. 酸性:HClO4>H2SO4>H3PO4
查看答案和解析>>
科目:高中化学 来源:2013-2014广东省惠州市高一下学期期末考试化学(理)试卷(解析版) 题型:选择题
烹鱼时加入少量食醋和料酒可以使烹制的鱼具有特殊的香味,这种香味来自于
A.食盐 B.食醋中的乙酸
C料酒中的乙醇 D.料酒中的乙醇与食醋中的乙酸反应生成的乙酸乙酯
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com