
【题目】工业上制取硝酸铵的流程图如下,请回答下列问题:
(1)合成氨的工业设备名称是 , 设备中设置热交换器的目的是;此生产过程中,N2与H2合成NH3所用的催化剂是;生产中原料气必须进行脱硫,目的是。
(2)吸收塔中的反应为 , 从生产流程看,吸收塔中需要补充空气,其原因是。
(3)生产硝酸的过程中常会产生一些氮的氧化物,可用如下三种方法处理:
方法一:碱吸收法:NO+NO2+2NaOH=2NaNO2+H2O,2NO2+Na2CO3=NaNO2+NaNO3+CO2
方法二:氨还原法:8NH3+6NO2=7N2+12H2O(该反应放热,NO也有类似的反应)
方法三:甲烷吸收法:CH4(g)+2NO2(g)=CO2(g)+N2(g)+2H2O(g) △H=+867kJ·mol-1(NO也有类似的反应)上述三种方法中方法一最大的缺点是;方法三和方法二相比,优点是 , 缺点是。
(4)某化肥厂用NH3制备NH4NO3。已知:由NH3制NO的产率是94%,NO制HNO3的产率是89%,则制HNO3所用的NH3的质量占总耗NH3质量(不考虑其他损耗)的%(保留三位有效数值)。
【答案】
(1)合成塔;利用余热,节约能源;铁砂网(或铁或铁触媒);防止催化剂中毒
(2)2NO+O2=2NO2 , 3NO2+H2O=2HNO3+NO(或4NO+3O2+2H2O=4HNO3);可使NO循环利用,提高原料利用率
(3)单独的NO不能被吸收;甲烷比氨价格便宜;耗能高
(4)54.4
【解析】解:(1)在合成氨的设备(合成塔)中,用到的催化剂是铁砂网,硫可使催化剂中毒(降低催化剂活性),设置热交换器的目的是利用余热,节约能源;
所以答案是:合成塔;利用余热,节约能源;铁砂网(或铁或铁触媒);防止催化剂中毒.
(2)在合成硝酸的吸收塔中不断通入空气,目的是提供充足的氧气,以便使NO循环利用,全部转化成硝酸;
所以答案是:2NO+O2=2NO2 , 3NO2+H2O=2HNO3+NO(或4NO+3O2+2H2O=4HNO3);可使NO循环利用,提高原料利用率.
(3) 根据“绿色化学”要求,从根本上减少或杜绝污染,尽可能使原料和利用率提高来看,符合绿色的要求.题中方法一碱吸收法中,NO与碱不反应,因此方法一最大 的缺点就是对单独的NO污染物没法吸收;方法三与方法二相比较而言,优点是原料甲烷比氨的单价要便宜,方法三更经济,但是甲烷吸收法的反应是吸热的,而氨 还原法的反应是放热的,因此方法三的缺点是耗能大.
所以答案是:单独的NO不能被吸收;甲烷比氨价格便宜;耗能高.
(4)由NH3制NO的产率是94%,NO制HNO3的产率是89%,根据氮原子守恒可知,NH3~NO~HNO3 , 则1mol氨气可制得硝酸1mol×94%×89%=0.8366mol;由HNO3+NH3=NH4NO3可知,该反应消耗的氨气的量为0.8366mol;制HNO3所用的NH3的量为1mol,总耗的氨气量为1mol+0.8366mol=1.8366mol,则制HNO3所用的NH3的质量占总耗NH3质量的百分数为:![]() ≈54.4%(保留三位有效数字);
≈54.4%(保留三位有效数字);
所以答案是:54.4.


科目:高中化学 来源: 题型:
【题目】有A、B、C、D四块金属片,用导线两两相连插入稀硫酸中,可以组成各种原电池。若A和B相连时,A为负极;C与D相连时,C溶解,D上有氢气生成;A与C相连时,C为正极;B与D相连时,电子由D极经导线流向B极,则这四种金属的活泼性由强到弱的顺序为( )
A. ABCDB. ACDBC. CADBD. BDCA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酰氯(SO2Cl2)常作氯化剂或氯磺化剂,用于制作药品、染料、表面活性剂等。有关物质的部分性质如下表:
物质 | 熔点/℃ | 沸点/℃ | 其它性质 |
SO2Cl2 | -54.1 | 69.1 | ①易水解,产生大量白雾 |
H2SO4 | 10.4 | 338 | 吸水性且不易分解 |
实验室用干燥、纯净的二氧化硫和氯气合成硫酰氯,装置如图所示(夹持仪器已省略),请回答有关问题:
(1)仪器A冷却水的进水口为(填“a”或“b”)。
(2)仪器B中盛放的药品是。
(3)实验时,装置丁中发生反应的离子方程式为。
(4)装置丙的作用为 , 若缺少装置乙,则硫酰氯会水解,该反应的化学
方程式为。
(5)少量硫酰氯也可用氯磺酸(ClSO3H)分解获得,该反应的化学方程式为:2ClSO3H=H2SO4+ SO2Cl2 , 此方法得到的产品中会混有硫酸。
①从分解产物中分离出硫酰氯的方法是。
②请设计实验方案检验产品中有硫酸(可选试剂:稀盐酸、稀硝酸、BaCl2溶液、蒸馏水、石蕊溶液):。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关化学键的类型说法正确的是( )
A. HCl溶液和NaCl溶液均通过离子导电,所以HCl和NaCl均是离子化合物
B. 非金属元素组成的化合物中只含共价键
C. H与O、H与N均可形成既含极性共价键又含非极性共价键的化合物
D. NaHCO3和HCOONa都只含离子键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将4mol A气体和2mol B气体在2L的密闭容器内混合,并在一定条件下发生如下反应:2A(g)+B(g)2C(g),若经2s后测得C的浓度为0.6molL﹣1 , 现有下列几种说法:
①用物质A表示的反应的平均速率为0.3molL﹣1s﹣1
②用物质B表示的反应的平均速率为0.6molL﹣1s﹣1
③2s时物质A的转化率为70%
④2s时物质B的浓度为0.7molL﹣1
其中正确的是( )
A.①③
B.①④
C.②③
D.③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】叠氮化物是一类重要化合物,在炸药、磁性化合物研究、微量元素测定方面越来越引起人们的重视,其中氢叠氮酸(HN3)是一种弱酸,分子结构示意图可表示为: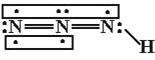
联氨被亚硝酸氧化时便可生成氢叠氮酸(HN3):N2H4+HNO2=2H2O+HN3
它的酸性类似于醋酸,微弱电离出H+和N。试回答下列问题:
(1)下列有关说法正确的是_____________(选填序号)。
A.HN3中含有5个σ键
B.HN3中三个氮原子采用的都是sp2杂化
C.HN3、HNO2、H2O、N2H4都是极性分子
D.肼(N2H4)沸点高达113.5℃,说明肼分子间可形成氢键
(2)叠氮化物能与Fe3+及Cu2+及Co3+等形成配合物,如:Co[(N3)(NH3)5]SO4 , 在该配合物中钴显价,根据价层互斥理论可知SO空间形状为 , 写出钴原子在基态时的核外电子排布式。
(3)由叠氮化钠(NaN3)热分解可得纯N2:2NaN3(s)=2Na(l)+3N2(g),有关说法正确的是_____(选填序号)
A.NaN3与KN3结构类似,前者晶格能较小
B.钠晶胞结构如上图,晶胞中分摊2个钠原子
C.氮的第一电离能大于氧
D.氮气常温下很稳定,是因为氮的电负性小
(4)与N互为等电子体的分子有(举2例)
(5)人造立方氮化硼的硬度仅次于金刚石而远远高于其它材料,因此它与金刚石统称为超硬材料。立方氮化硼晶胞如下图所示,试分析: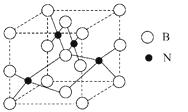
①该晶体的类别为晶体。
②晶体中每个N同时吸引个B。
③设该晶体的摩尔质量为M g·mol-1 , 晶体的密度
为ρg·cm-3 , 阿伏加德罗常数的值为NA , 则晶体
中两个距离最近的B之间的距离为cm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列现象与胶体的性质无关的是
A. 将盐卤或石膏加入豆浆中,制成豆腐
B. 一支钢笔使用两种不同型号的蓝黑墨水,易出现堵塞
C. 向FeCl3溶液中加入NaOH溶液,会出现红褐色沉淀
D. 清晨,人们经常看到阳光穿过茂密的树木枝叶所产生的美丽景象
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是炭和水蒸汽发生反应生成CO、H2的途径和三个状态的能量,该反应为吸热反应.试问: 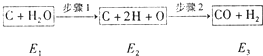
(1)步骤1、2分别是吸热过程还是放热过程?步骤1:;步骤2:;
(2)比较E1、E2、E3的大小: . (用“>”、“<”或“=”连接)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com