
| A. | 水 | B. | 碘化钾溶液 | C. | 氯化亚铁溶液 | D. | 氢氧化钠溶液 |
分析 A、氯水为黄绿色;
B、氯气具有氧化性,碘离子具有还原性,利用氧化还原反应来分析,且碘单质遇淀粉变蓝;
C、含亚铁离子的溶液为浅绿色,含三价铁离子的溶液为黄色;
D、氢氧化钠溶液为无色,氯气与氢氧化钠反应生成氯化钠和次氯酸钠也是无色溶液.
解答 解:A、氯气中加入水,得到的液体为黄绿色,则不符合题意,故A错误;
B、因氯气能氧化碘化钾生成碘单质,使淀粉变蓝,则不符合题意,故B错误;
C、因氯气能氧化亚铁离子变成铁离子,溶液由浅绿色变为黄色,则不符合题意,故C错误;
D、因氢氧化钠溶液为无色,且氯气与氢氧化钠反应生成氯化钠和次氯酸钠盐都为无色溶液,则符合题意,故D正确;
故选D.
点评 本题考查氯气的化学性质,明确氯气的氧化性使解答本题的关键,并应熟悉常见离子在溶液中的颜色、物质的特性等来解答即可.


科目:高中化学 来源: 题型:解答题
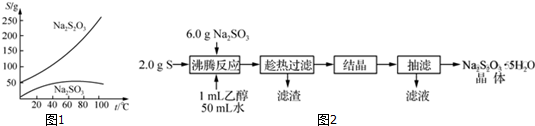
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ①③ | C. | ①④ | D. | ③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
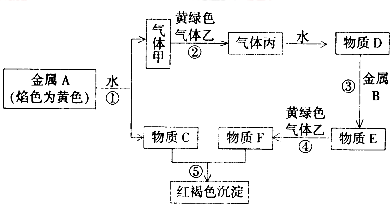
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
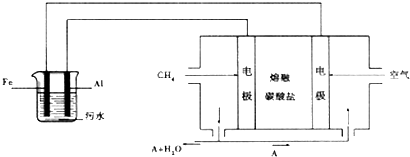
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
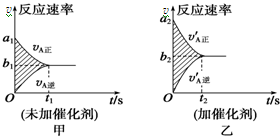 可逆反应mA(g)+nB(g)?pC(g)+gD(g)的v-t图象如图甲所示,若其他条件都不变,只是在反应前加入合适的催化剂,则其v-t图象如图乙所示.
可逆反应mA(g)+nB(g)?pC(g)+gD(g)的v-t图象如图甲所示,若其他条件都不变,只是在反应前加入合适的催化剂,则其v-t图象如图乙所示.| A. | ②④⑥⑦ | B. | ②④⑤⑧ | C. | ②③⑤⑦ | D. | ②③⑥⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 合成氨生产过程中将NH3液化分离,会降低反应速率,但可提高N2、H2的转化率 | |
| B. | 从海水提取镁的过程中,电解熔融的MgO制备Mg | |
| C. | 合成氨工业温度选择为450℃,主要是为了提高化学反应速率 | |
| D. | 电解饱和食盐水制烧碱时,应在阴极室加入饱和NaCl溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com