
 .
.分析 (1)铁在第四周期第ⅤⅢ族,价电子3d64s2,基态Al原子的核外电子排布为三个电子层,L层有8个电子分别位于sp亚层;
(2)乙醛中甲基上的C采取sp3杂化类型,醛基中的C采取sp2杂化类型;1个乙酸分子含有7个σ键和一个π键;
(3)铜为29号元素位于第四周期第ⅠB族,据此书写电子排布式,根据元素的电负性在周期表中的递变规律判断B、C、N元素的电负性由大到小的顺序,同周期元素从左到右元素的电负性逐渐增强;
(4)价层电子对互斥模型(简称VSEPR模型),根据价电子对互斥理论,价层电子对个数=σ键个数+孤电子对个数.σ键个数=配原子个数,孤电子对个数=$\frac{1}{2}$×(a-xb),a指中心原子价电子个数,x指配原子个数,b指配原子形成稳定结构需要的电子个数;分子的立体构型是指分子中的原子在空间的排布,不包括中心原子未成键的孤对电子;实际空间构型要去掉孤电子对,略去孤电子对就是该分子的空间构型.
价层电子对个数为4,不含孤电子对,为正四面体结构;含有一个孤电子对,空间构型为三角锥形,含有两个孤电子对,空间构型是V型;
价层电子对个数为3,不含孤电子对,平面三角形结构;含有一个孤电子对,空间构型为为V形结构;
价层电子对个数是2且不含孤电子对,为直线形结构;
(5)利用均摊法计算两种金属原子个数之比,根据ρ=$\frac{m}{V}$计算.
解答 解:(1)Fe元素位于元素周期表的第四周期第ⅤⅢ族,价电子3d64s2,为周期表中的d区,基态Al原子的核外电子排布为三个电子层,L层有8个电子分别位于sp亚层态Al原子的L层电子排布图为 ,
,
故答案为:d; ;
;
(2)乙醛中甲基上的C形成4条σ键,无孤电子对,因此采取sp3杂化类型,醛基中的C形成3条σ键和1条π键,无孤电子对,采取sp2杂化类型;1个乙酸分子含有7个σ键和一个π键,则1mol乙酸含有7molσ键,即7NA个σ键,
故答案为:sp3、sp2;7NA ;
(3)铜为29号元素位于第四周期第ⅠB族,原子的价电子排布式3d104s1,一价铜离子的电子排布式为1s22s22p63s23p63d10(或[Ar]3d10),B、C、N元素的电负性由大到小的顺序,同周期元素从左到右元素的电负性逐渐增强,碳、硼、氮元素的电负性由大到小的顺序是N>C>B,
故答案为:1s22s22p63s23p63d10(或[Ar]3d10); N>C>B;
(4)氨气分子中价层电子对个数=σ键个数+孤电子对个数=3+$\frac{1}{2}$(5-3×1)=4,VSEPR模型为正四面体结构;含有一个孤电子对,所以其空间构型为三角锥形,
故答案为:四面体;
(5)在晶胞中,Ag原子位于顶点,Cu原子位于面心,该晶胞中Ag原子个数=8×$\frac{1}{8}$=1,Cu原子个数=6×$\frac{1}{2}$=3,所以该合金中Ag原子与Cu原子个数之比=1:3,
晶胞体积V=(r×10-10cm)3,每个晶胞中铜原子个数是3、Ag原子个数是1,则ρ=$\frac{\frac{108+64×3}{NA}}{(r×1{0}^{-10})^{3}}$=$\frac{3.0×1{0}^{32}}{{r}^{3}{N}_{A}}$g•cm-3,
故答案为:$\frac{3.0×1{0}^{32}}{{r}^{3}{N}_{A}}$.
点评 本题考查物质的结构与性质,注重对电子排布式、化学键类型、杂化理论的应用、晶体结构考查,考查点较多,题目难度中等,侧重考查学生对知识的迁移应用,注意信息的理解和综合应用.


 快乐暑假暑假能力自测中西书局系列答案
快乐暑假暑假能力自测中西书局系列答案科目:高中化学 来源: 题型:选择题
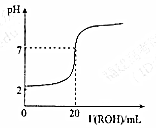 室温时,往20mL 0.1mol•L-1的HM酸溶液中逐滴滴入0.1mol•L-1的ROH碱溶液,溶液的pH与所加的ROH溶液的体积关系如图所示,下列说法正确的是( )
室温时,往20mL 0.1mol•L-1的HM酸溶液中逐滴滴入0.1mol•L-1的ROH碱溶液,溶液的pH与所加的ROH溶液的体积关系如图所示,下列说法正确的是( )| A. | V(ROH)<20mL时,随着V(ROH)增大,HM的电离程度减小 | |
| B. | K(HM)=K(ROH) | |
| C. | RM不能发生水解反应 | |
| D. | V(ROH)>20mL时,溶液中c(R+)<c(M-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
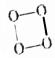 的O4是一种价格超过黄金的气体,下列有关O4的说法中不正确的是( )
的O4是一种价格超过黄金的气体,下列有关O4的说法中不正确的是( )| A. | O4与O3、O2互为同素异形体 | |
| B. | O4与H2反应生成冰 | |
| C. | O4中各原子最外电子层均达到8电子结构 | |
| D. | O4的化学性质一定比O2稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 离子种类 | 开始沉淀的pH | 完全沉淀的pH |
| Fe3+ | 1.9 | 3.2 |
| Cu2+ | 4.7 | 6.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 固体活性炭/mol | NO/mol | A/mol | B/mol | |
| 200℃ | 2.000 | 0.0400 | 0.0300 | 0.0300 |
| 335℃ | 2.005 | 0.0500 | 0.0250 | 0.0250 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.4g乙烯和丙烯混合气体中含有C-H键的数目为0.2NA | |
| B. | 0.10molFe粉与足量水蒸气反应生成的H2分子数为0.10NA | |
| C. | 标准状况下,11.2LCO2与足量Na2O2反应,转移的电子数为NA | |
| D. | 若将1mol氧化铁完全转化为氢氧化铁胶体,则分散系中胶体粒子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | MnO2+4HCl(浓)→MnCl2+Cl2↑+2H2O | |
| B. | Ag+2HNO3(浓)→AgNO3+NO2↑+H2O | |
| C. | C+2H2SO4(浓)→CO2↑+2SO2↑+2H2O | |
| D. | 3Fe3O4+28HNO3(浓)→9Fe(NO3)3+NO↑+14H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
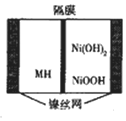 一种新型金属氢化物镍电池(MH-Ni电池,MH为贮氢材料)工作原理如图所示.下列有关说法正确的是( )
一种新型金属氢化物镍电池(MH-Ni电池,MH为贮氢材料)工作原理如图所示.下列有关说法正确的是( )| A. | 隔膜为阴离子交换膜 | |
| B. | 电池的电解液可为硫酸 | |
| C. | 充电时阳极反应为H2O+M+e-═MH+OH- | |
| D. | 放电时负极反应为Ni(OH)2+OH--e-═NiOOH+H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com