
| A. | 氧化剂与还原剂的物质的量之比为1:6 | |
| B. | 氧化产物与还原产物的质量之比为1:1 | |
| C. | 生成3mol水时有1mol KIO3被氧化 | |
| D. | 1mol KIO3参加反应时有5mol电子转移 |
分析 反应KIO3+6HI═3I2+KI+3H2O中,HI中I元素的化合价由-1价升高0,KIO3中I元素的化合价由+5价降低为0,以此来解答.
解答 解:A.反应中KIO3为氧化剂,HI为还原剂,氧化剂与还原剂的物质的量之比为1:5,故A错误;
B.氧化剂和还原剂的物质的量之比是1:5,故B错误;
C.KIO3为氧化剂,被还原,故C错误;
D.KIO3中I元素的化合价由+5价降低为0,则1mol KIO3参加反应时有5mol电子转移,故D正确.
故选D.
点评 本题考查氧化剂、还原剂及氧化还原反应的计算,侧重考查基本概念和计算,明确元素化合价变化即可解答,熟练掌握常见元素化合价,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 非自发反应在任何条件下都不能实现 | |
| B. | 自发反应都是熵增大的反应 | |
| C. | 能自发进行的吸热反应一定是熵增大的反应 | |
| D. | 自发反应都是放热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
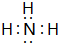 ;分子中既含有极性共价键、又含有非极性共价键的18电子化合物有H2O2、N2H4(写出其中两种的化学式).
;分子中既含有极性共价键、又含有非极性共价键的18电子化合物有H2O2、N2H4(写出其中两种的化学式).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Mg2+、Fe3+、NO3-、SCN- | B. | Al3+、Fe2+、Cl-、SO42- | ||
| C. | K+、Na+、Cl-、HCO3- | D. | Na+、Ca2+、NO3-、OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ?达到化学平衡时?4v正(O2)=5v逆(NO) | |
| B. | ?若单位时间内生成x mol NO的同时消耗x mol NH3?则反应达到平衡状态 | |
| C. | ?达到化学平衡时若增大容器体积,则正反应速率减小,逆反应速率增大 | |
| D. | ?当混合气体的压强不随时间变化时,此反应达平衡 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
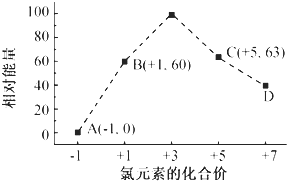 元素周期表的用途广泛.
元素周期表的用途广泛.| 离子半径 | 非金属性 | 酸性 | 沸点 |
| K+<S2- | N<O | 硫酸<高氯酸 | HF>HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入催化剂能加快反应速率 | |
| B. | 增大压强能减慢反应速率 | |
| C. | 达到平衡时,反应速率:v(正)=v(逆)=0 | |
| D. | 达到平衡时,N2和H2能100%转化为NH3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com