
| A. | 测0.1 mol/L氨水的pH为11:NH3•H2O?NH4++OH- | |
| B. | 将Na块放入水中,产生气体:2Na+2H2O═2NaOH+H2↑ | |
| C. | 用CuCl2溶液做导电实验,灯泡发光:CuCl2═Cu2++2Cl- | |
| D. | Al片溶于NaOH溶液中,产生气体:2Al+2OH-+2H2O═2AlO2-+3H2↑ |
分析 A.一水合氨为弱电解质,部分电离,应可逆号;
B.钠与水反应生成氢氧化钠和氢气;
C.电解氯化铜反应生成铜和氯气;
D.铝与氢氧化钠溶液反应生成偏铝酸钠和氢气.
解答 解:A.测0.1 mol/L氨水的pH为11,说明一水合氨为弱电解质,部分电离,电离方程式:NH3•H2O?NH4++OH-,故A正确;
B.将Na块放入水中,产生气体,离子方程式:2Na+2H2O═2NaOH+H2↑,故B正确;
C.用CuCl2溶液做导电实验,灯泡发光,电解离子方程式:CuCl2$\frac{\underline{\;电解\;}}{\;}$Cu+Cl2↑,故C错误;
D.Al片溶于NaOH溶液中,产生气体,离子方程式:2Al+2OH-+2H2O═2AlO2-+3H2↑,故D正确;
故选:C.
点评 本题考查了离子方程式书写,涉及电离方程式、电解方程式书写,明确反应实质是解题关键,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 目前加碘食盐中含碘元素的物质主要是KIO3 | |
| B. | 维生素C具有还原性,可用作食品抗氧化剂 | |
| C. | 向含有Hg2+的废水中加入Na2S,使Hg2+转化成HgS沉淀除去 | |
| D. | 淀粉、油脂和蛋白质都是天然高分子化合物,都能发生水解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③⑤ | B. | ①②③⑤ | C. | ①②④⑤ | D. | 全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
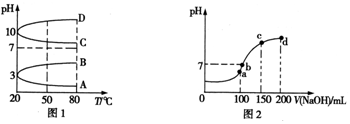
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 纯净物 | 盐 | 碱性氧化物 | 酸性氧化物 |
| A | 碱石灰 | 烧碱 | 氧化铝 | 二氧化碳 |
| B | NH3•H2O | 小苏打 | 氧化镁 | 二氧化氮 |
| C | 五水硫酸铜 | 纯碱 | 氧化钠 | 三氧化硫 |
| D | H2O2 | 苏打 | 过氧化钠 | 二氧化硫 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
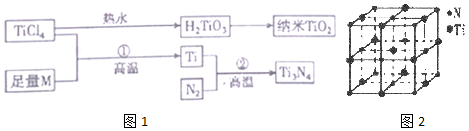
| I1 | I2 | I3 | I4 | I5 | |
| 电离能/(kJ•mol-1) | 738 | 1451 | 7733 | 10 540 | 13 630 |
| 离子晶体 | NaCl | KC1 | CaO |
| 晶格能/(kJ•mol-1) | 786 | 715 | 3401 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 常温常压下,46 gN2O4中含氧原子数为2NA | |
| B. | 常温常压下,11.2 LNH3中含共价键的数目为1.5NA | |
| C. | 电解精炼铜阳极质量减少32 g时电路中转移电子总数为NA | |
| D. | 1 L 0.2 mol/LNa2SO4溶液中含有阴阳离子总数为0.6NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
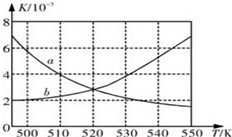 Ⅰ:为了减少CO的排放,某环境研究小组以CO和H2 为原料合成清洁能源二甲醚(DME),反应如下:4H2(g)+2CO(g)
Ⅰ:为了减少CO的排放,某环境研究小组以CO和H2 为原料合成清洁能源二甲醚(DME),反应如下:4H2(g)+2CO(g)| 时间/min | 0 | 20 | 40 | 80 | 100 |
| n(H2)/mol | 2.0 | 1.4 | 0.85 | 0.4 | - |
| n(CO)/mol | 1.0 | - | 0.425 | 0.2 | 0.2 |
| n(CH3OCH3)/mol | 0 | 0.15 | - | - | 0.4 |
| n(H2O)/mol | 0 | 0.15 | 0.2875 | 0.4 | 0.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 11.2 L CO2所含分子数为0.5 NA | |
| B. | 32gO2和O3的混合气体中含有的氧原子数为2NA | |
| C. | 标况下,11.2L乙醇(C2H5OH)中所含的碳原子数目为NA | |
| D. | 14.2 g Na2SO4固体中阴离子所带电荷数为0.1NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com