
| A. | 刚玉--SiO2 | B. | 明矾--Al2(SO4)3•12H2O | ||
| C. | 小苏打--Na2CO3 | D. | 漂白粉--Ca(ClO)2、CaCl2 |
分析 A、刚玉是氧化铝;
B、明矾是KAl(SO4)2•12H2O的俗称;
C、小苏打是NaHCO3的俗称;
D、漂白粉是氯气和氢氧化钙的反应产物.
解答 解:A、刚玉是氧化铝的俗称,石英的主要成分是二氧化硅,故A错误;
B、明矾是KAl(SO4)2•12H2O的俗称,可用作净水剂,故B错误;
C、小苏打是NaHCO3的俗称,碳酸钠俗称苏打,故C错误;
D、漂白粉是氯气和氢氧化钙的反应产物,故主要成分是Ca(ClO)2、CaCl2,故D正确.
故选D.
点评 本题考查了化学物质的名称与化学式的关系,题目难度不大,试题侧重基础知识的考查,注意掌握常见化学物质的名称、化学式,试题培养了学生灵活应用所学知识的能力.


科目:高中化学 来源: 题型:选择题

| A. | 图①表示向含Mg2+、Al3+、NH4+的盐溶液中滴加NaOH溶液时,沉淀的量与NaOH的体积的关系图.则三种离子的物质的量之比为:n(Mg2+):n(Al3+):n( NH4+)=2:3:2 | |
| B. | 图①中使用的NaOH的浓度为2 mol/L | |
| C. | 图②表示25℃时,用0.1 mol•L-1盐酸滴定20 mL 0.1 mol•L-1 NaOH溶液,溶液的pH随加入酸体积的变化 | |
| D. | 图③中曲线表示3H2(g)+N2(g)═2NH3(g)反应过程的能量变化.若使用催化剂,B点会降低 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 16O和18O的原子结构示意图均为 | |
| B. | 在Na2O2和CaCl2中均含有共价键和离子键 | |
| C. | 结构示意图为 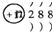 的阴离子都不能破坏水的电离平衡 的阴离子都不能破坏水的电离平衡 | |
| D. | 电子式 可以表示羟基,也可以表示氢氧根离子 可以表示羟基,也可以表示氢氧根离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 还原剂 | B. | 氧化剂 | ||
| C. | 既是氧化剂又是还原剂 | D. | 既不是氧化剂又不是还原剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 合理膳食、合理用药是人体健康的需要.
合理膳食、合理用药是人体健康的需要.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
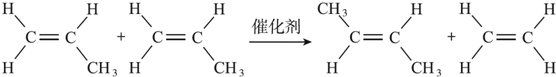
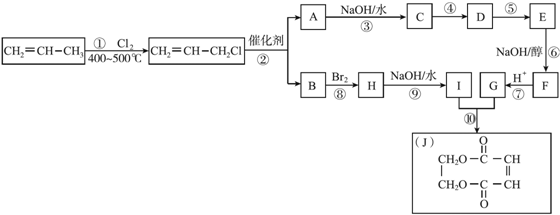
 +CH2=CH2.
+CH2=CH2.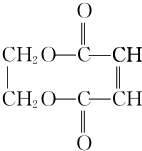 +2H2O.
+2H2O.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com